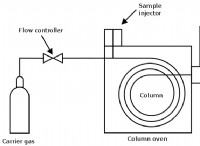
쉘 수가 증가함에 따라 전자 쉘의 에너지가 증가합니다. 이것은 더 높은 쉘의 전자가 하부 껍질의 전자보다 더 많은 에너지를 가지고 있음을 의미합니다. 전자의 에너지는 또한 그것이 차지하는 서브 쉘에 따라 다릅니다. 서브 쉘은 문자 S, P, D 및 F로 지정되며 각 서브 쉘은 다른 에너지 수준을 갖습니다.
에너지 수준에서 전자의 배열은 Pauli 배제 원리에 의해 결정되며, 이는 원자의 두 전자가 동일한 양자 수 세트를 가질 수 없음을 나타냅니다. 이 원칙은 각 전자가 고유 한 에너지 수준을 차지해야 함을 의미합니다.
전자의 에너지 수준은 화학 결합, 분광법 및 자기를 포함하여 원자 구조 및 행동의 여러 측면에서 결정적인 역할을합니다.