이유는 다음과 같습니다.
* 금속 결합 : 금속은 가장 바깥 쪽 전자가 느슨하게 고정되어 있으며 원자 사이를 쉽게 이동할 수있는 독특한 유형의 결합을 가지고 있습니다. 이것은 열과 전기의 전도도가 우수한 "전자 바다"를 만듭니다.
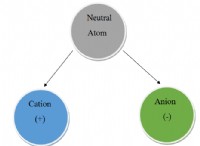
* 낮은 이온화 에너지 : 금속은 일반적으로 이온화 에너지가 낮습니다. 이는 금속 원자에서 전자를 제거하는 데 상대적으로 적은 에너지가 필요하여 전자를 잃고 긍정적으로 하전 된 이온 (양이온)이되기를 간절히 원합니다.
전자를 쉽게 잃는 금속의 예 :
* 알칼리 금속 (그룹 1) : 리튬 (Li), 나트륨 (NA), 칼륨 (K) 등.이 금속은 하나의 원자가 전자를 가지므로 극도로 반응성이 높고 전자를 +1 이온을 형성하기 쉽다.
* 알칼리성 지구 금속 (그룹 2) : 베릴륨 (BE), 마그네슘 (MG), 칼슘 (CA) 등.이 금속에는 2 개의 원자가 전자가 있으며 +2 이온을 형성하는 경향이 있습니다.
* 전이 금속 : 많은 전이 금속은 전자를 잃어 다양한 양의 이온을 형성하여 다양한 화학적 거동에 기여할 수 있습니다.
중요한 참고 : 모든 금속이 똑같이 쉽게 전자를 잃는 것은 아닙니다. 그들의 반응성과 전자를 잃는 경향은주기적인 표에서의 위치와 전기 음성과 같은 다른 요인에 의존합니다.