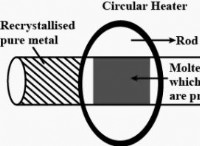
* 이온 결합 : NaCl은 이온 결합을 통해 형성됩니다. 나트륨 (NA)은 금속이며 전자를 쉽게 손실하여 양으로 하전 된 이온 (Na+)이됩니다. 염소 (CL)는 비금속이며 전자를 쉽게 이득하여 음으로 하전 된 이온 (Cl-)이됩니다. 이 반대로 하전 된 이온들 사이의 강한 정전기 인력은 이온 결합을 만듭니다.
* 극성 대 비극성 공유 결합 : "Polar"및 "Nonpolar"라는 용어는 공유 결합의 유형을 설명하는 데 사용됩니다 여기서 원자가 전자를 공유합니다. NaCl과 같은 이온 결합은 공유가 아닌 전자의 완전한 전달을 포함합니다.
다른 질문이 있으면 알려주세요!