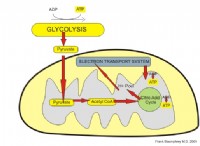
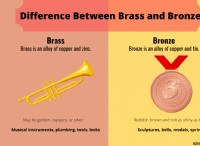
다음은 고장입니다.
* isoelectronic : k 2+ 및 cl - 같은 수의 전자가 있습니다 (18). 이것은 전자 구조와 크기의 유사성을 나타낼 수 있습니다.
* 이온화 에너지 : 칼륨의 두 번째 이온화 에너지 (두 번째 전자를 제거하기 위해)는 매우 높습니다. 이것은 k 2+ 을 형성하기 위해서는 많은 양의 에너지가 필요하다는 것을 의미합니다. 에너지가 불리하게 만듭니다.
* 전기 음성 : 칼륨은 고도로 전기 양성 요소이며, 즉 k + 을 형성하기 위해 하나의 전자를 쉽게 잃게됩니다. . 이것은 전자 구성으로 인해 칼륨에서 가장 안정적인 이온 상태입니다.
결론 : 염소와의 등성 관계는 k 2+ 의 존재에 대한 이론적 근거를 제공 할 수 있습니다. , 높은 두 번째 이온화 에너지와 칼륨의 전자를 잃는 경향은 K 2+ 의 형성을 만듭니다. 매우 가능성이 낮습니다.