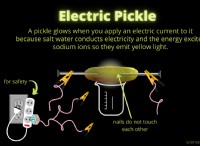
* 반응성 액체 : 이것은 물질이 화학적으로 활성이라는 것을 알려줍니다. 즉, 화학 반응에 쉽게 참여합니다.
* 전기를 전도하지 않습니다 : 이것은 물질이 비 전해질임을 나타냅니다. 비 전해질은 용액에 자유 변형 이온 (하전 입자)이 없으며, 이는 전기 전도도에 필요합니다.
* ancomency in 화합물 : 원자가는 요소의 결합 용량을 나타냅니다. 1의 원자가는 원소가 하나의 화학적 결합을 형성 할 수 있음을 의미합니다.
여기에 문제가 있습니다 :
* 비 전해질은 일반적으로 이온 성 화합물을 형성하지 않습니다. 이온 성 화합물은 양의 및 음으로 하전 된 이온 사이의 정전기 인력에 의해 함께 유지된다. 이 이온은 용액에서 전기 전도성을 허용하는 것입니다.
* 원자가 1은 일반적으로 요소가 이온 결합을 형성 함을 나타냅니다. 1 인 원소는 일반적으로 안정적인 전자 구성을 달성하기 위해 하나의 전자를 잃거나 얻는다.
예 :
* 나트륨 (NA)은 1의 원자가를 가지며 Na+ 이온을 형성합니다. 염화나트륨 (NaCl)은 물에 용해 될 때 전기를 전도하는 고전적인 이온 성 화합물입니다.
* 염소 (CL)는 또한 1의 원자가를 가지며 cl- 이온을 형성합니다. 다시, 이것은 이온 성 화합물 형성으로 이어진다.
결론 :
전기를 전도하지 않는 반응성 액체가 화합물에서 1의 원자가를 가질 가능성은 거의 없습니다. 이 조합은 원자가 1을 가진 요소의 전형적인 동작과 모순됩니다.
가능한 예외 :
특이한 특성을 가진 고도로 공유 화합물과 관련된 매우 구체적이고 드문 예외가있을 수 있습니다. 그러나 이것들은 일반적인 규칙이 아닙니다.