주요 차이 - 등가 지점 대 종말점
적정 방법은 종종 용액 혼합물에서 구성 요소를 식별하고 정량화하는 데 사용됩니다. 일부 적정은 화학 반응의 끝을 나타내는 데 도움이되는 지표와 함께 수행됩니다. 이 표시는 시스템의 색상을 변경하여 제공됩니다. 그러나 일부 반응물은 지표 자체로 작용합니다. 따라서 지표가 모든 시스템에서 사용되는 것은 아닙니다. 적정의 결과는 주로 다른 사람들이 다른 지점에서 적정의 종말점을 식별하기 때문에 적정을하는 사람에 따라 다릅니다. 그러나 종말점은 반응이 실제로 끝나는 지점이 아닙니다. 반응의 끝은 등가 지점에 의해 주어진다. 종말점은 등가 지점에 도달했음을 나타냅니다. 등가 지점과 종말점의 주요 차이점은 등가 지점이 화학 반응이 끝나는 실제 지점이라는 것입니다 엔드 포인트는 시스템에서 색상 변화가 발생하는 지점입니다.
주요 영역을 다루었습니다
1. 동등한 점
- 정의, 속성, 예
2. 엔드 포인트가 뭐야
- 정의, 속성, 예
3. 등가 지점과 엔드 포인트의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :종말점, 등가 지점, 지표, 몰토리, 페놀프탈 레인, 적정 
등가 점
등가 점은 적정 혼합물의 화학 반응이 끝나는 실제 지점입니다. 적정은 종종 액체에서 물질의 농도를 결정하기 위해 수행된다. 물질이 알려진 경우, 우리는 물질과 반응 할 수있는 공지 된 농도와 함께 적정 (액체 혼합물에서 성분의 농도를 결정하는 데 사용되는 용액)을 사용할 수 있습니다. 적합성은 정확한 몰토리가 알려져 있기 때문에 표준 솔루션이라고합니다.
예를 들어, NAOH와 HCL 사이의 반응을 고려해 봅시다. 이것은 산베이스 반응입니다. 우리는 NAOH 또는 HCL을 농도의 적목으로 사용할 수 있습니다. 적목은 뷰렛에 배치되며 반응 혼합물에서 색상 변화가 발생할 때까지 역가/분석 물에 천천히 첨가된다. NAOH 또는 HCL이 자체 표시기가 아니기 때문에 표시기를 사용해야합니다. 색상 변화가 발생하는 지점은 적정의 종말점으로 취해집니다. 그러나 그것은 반응의 동등성 지점이 아닙니다.
여기서, 동등한 점은 모든 HCl 분자가 NaOH와 반응 한 지점 (또는 모든 NAOH 분자가 HCl과 반응 한 지점)입니다. 여기서, 적목의 두부는 알려지지 않은 분석 물의 두더지와 같아야합니다.
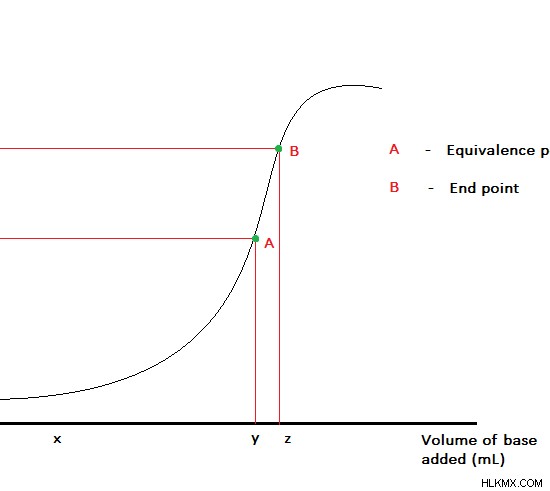
그림 1 :염기를 갖는 산의 적정을위한 적정 곡선
등가 지점을 결정하는 방법
- 자체 표시기의 색상 변화 -자가 인디케이터를 반응물로 포함하는 반응에서 색상 변화는 지표가 사용되지 않기 때문에 적정의 동등성 지점을 나타냅니다. .
- 엔드 포인트 - 때로는 등가 지점이 대략 동일하기 때문에 엔드 포인트로 간주 될 수 있습니다.
- 컨덕턴스 - 컨덕턴스를 사용하여 적정의 동등성 점을 결정할 수도 있습니다. 여기서, 컨덕턴스는 적정 전체에 걸쳐 측정되어야하며, 등가 지점은 빠른 전도체 변화가 발생하는 곳입니다. 이것은 약간 어려운 방법입니다.
- 분광법 -이 방법은 화려한 반응 혼합물에 사용될 수 있습니다. 결정은 샘플에 흡수되는 파장의 빠른 변화에 따라 수행됩니다.
endpoint
적정의 끝점은 색상 변화가 발생하는 지점입니다. 일반적으로 산과 염기는 무색 솔루션입니다. 따라서, 산의 염기와의 중화 반응의 끝을 결정하기 위해, pH의 변화로 반응 혼합물의 색을 변화시킬 수있는 지표가 사용된다. 예를 들어, Phenolphthalein은 산 기본 반응에 사용되는 공통 지표입니다. 이 표시기의 색상 변화는 8.3 (무색) 및 10.0 (분홍색)으로 제공됩니다. 그러나이 지표는 낮은 pH 값에서 발생하는 반응에 적합하지 않습니다. 따라서 표시기는 그에 따라 선택해야합니다.

그림 2 :다른 pH 값에서 페놀프탈레인의 색
엔드 포인트는 미지의 총량이 적목과 완전히 반응 한 지점이 아닙니다. 자기 표시기가 관여하는 반응에서, 미지의 전체 양이 적정적으로 반응했을 때 종말점이 주어진다. 따라서 종말점은 여기서 동등성 지점과 같습니다. 예를 들어, Cr 2 의 전환의 반 반응 o 7 C로, 매체의 색상이 오렌지에서 녹색으로 변경됩니다. 수용액에서 Cr (+6)의 색이 주황색이고 수용액에서 Cr (+3)의 색이 녹색이기 때문입니다. 따라서이 색상 변화는 그 반응의 종말점으로 간주됩니다.
등가 지점과 엔드 포인트의 차이
정의
등가 지점 : 등가 지점은 적정 혼합물의 화학 반응이 끝나는 실제 지점입니다.
엔드 포인트 : 적정의 끝점은 색상 변화가 발생하는 지점입니다.
화학량 측정법
등가 지점 : 등가 지점은 미지의 분석 물이 적목과 완전히 반응 한 지점을 제공합니다.
엔드 포인트 : Endpoint는 항상 알 수없는 분석 물이 적목과 완전히 반응 한 지점을 제시하는 것은 아닙니다.
색상 변화
등가 지점 : 반응 혼합물의 색 변화가 항상 정확한 등가 지점을 나타내는 것은 아닙니다.
엔드 포인트 : 색상 변화는 항상 종말점을 나타냅니다.
반응 종료
등가 지점 : 등가 점은 반응이 끝나는 지점을 제공합니다.
엔드 포인트 : 엔드 포인트는 항상 반응의 끝만 제공하지는 않습니다.
결론
엔드 포인트는 일반적으로 등가 지점으로 간주되지만 동일하지 않습니다. 그러나 등가 지점과 엔드 포인트 사이에는 약간의 차이가 있기 때문에 실험실 관행에 대해 동일하게 간주 될 수 있습니다. 종말점은 항상 등가 지점에 이어집니다. 등가 지점과 엔드 포인트의 주요 차이점은 등가 지점이 반응의 끝이지만 엔드 포인트는 색상 변화가 발생하는 지점이라는 것입니다.