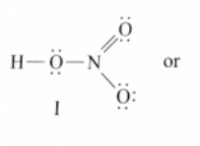
이유는 다음과 같습니다.
* 전기 음성 : 이것은 원자가 화학적 결합으로 전자를 자체로 끌어들이는 경향입니다. 질소와 산소는 상대적으로 높은 전기 음성 값을 갖는다.
* 전자 친화력 : 이것은 전자가 중성 원자에 첨가 될 때 에너지의 변화입니다. 질소와 산소는 양의 전자 친화도를 가지며 전자를 얻을 때 유리한 에너지 변화를 나타냅니다.
이러한 특성은 전자를 잃고 전자를 잃고 긍정적으로 하전 된 이온 (양이온)을 형성하기보다는 전자를 얻고 음이온 (음이온)을 더 쉽게 형성 할 수있게한다.
예 :
* 질소 (N) 전기성이 3.04이고 질화 마그네슘 (Mg₃n₂)과 같은 화합물에서 질화물 이온 (N³⁻)을 형성한다.
* 산소 (O) 전기 음성화는 3.44이며 산수 나트륨 (Na₂O)과 같은 화합물에서 산화물 이온 (O²⁻)을 형성합니다.
양의 이온이 아닌 이유는 무엇입니까?
질소와 산소는 양의 이온을 형성하기 위해 전자를 잃어야합니다. 그러나 이것은 핵과 전자 사이의 강력한 매력을 극복하기 위해 상당한 양의 에너지가 필요합니다. 전자를 잃고 간단한 이진 화합물에서 양이온이되는 것은 에너지 적으로 바람직하지 않습니다.
예외 :
질소와 산소는 일반적으로 음이온을 형성하지만, 복잡한 화합물과 특정 조건 하에서 양성 이온을 형성 할 수있는 예외가있다.
예를 들어:
* 질소 NOA (니트로늄 이온)와 같은 화합물에서 양이온을 형성하여 산소와 강한 결합을 형성 할 수 있습니다.
* 산소 강한 산화제의 존재와 같이 극한 조건에서 OATERE (이산 소화)와 같은 화합물에서 양이온을 형성 할 수 있습니다.
그러나, 단순한 이진 화합물에서, 그들의 높은 전기 음성 성 및 유리한 전자 친화력은 전자를 얻고 음이온을 형성 할 가능성이 훨씬 높아집니다.