염소는 주기율표의 17 요소입니다. 이러한 염소 사실에는 일반 정보 및 이력과 함께 화학 및 물리적 데이터가 포함되어 있습니다.

염소 주기성 테이블 세포
기본 염소 사실
이름 : 염소
원자 번호 : 17
요소 기호 : cl
그룹 : 17
기간 : 3
블록 : p
요소 가족 : 할로겐
원자 질량 : [35.446; 35.457]
IUPAC 지침 마그네슘 샘플의 물리적 및 화학 병력을 반영합니다. 원자 질량의 단일 값이 필요한 경우 35.4527을 사용하십시오.
전자 구성 : [NE] 3S3P (속기) 또는 1S2S2P3S3P (Full)
발견 : 1774 년 Carl Wilhelm Scheele
염산으로부터의 실레 분리 염소. 그는 그가 수집 한 노란색 가스가 새로운 요소가 아니라 다른 화합물의 산화물이라고 생각했습니다. Humphry Davy 경이 염소 가스에 산소가 없음을 보여 주었을 때이 믿음은 1811 년까지 계속되었습니다. 염소는 고유 한 요소였습니다.
이름 원산지 : Davy는 그리스어 단어의 새로운 요소 클로린을 명명했습니다. 황록색을 의미합니다.
동위 원소 :
천연 염소는 두 가지 안정적인 동위 원소로 구성됩니다 :Cl 및 Cl. CL에서 CL까지의 27 개 방사성 동위 원소가 존재합니다.
Cl
염소 -35는 18 중성자를 함유하는 안정적인 동위 원소이다. 천연 염소의 75.77%는 염소 -35입니다.
Cl
염소 -37은 20 개의 중성자를 함유하는 안정적인 동위 원소이다. 천연 염소의 24.23%는 염소 -37입니다.
Cl
염소 -36은 19 중성자를 함유하는 방사성 동위 원소이다. 우주 방사선이 대기 염소와 상호 작용할 때 형성됩니다. 염소 -36은 시간의 AR 98.1%로 β- 붕괴에 의한 붕괴 또는 전자 캡처 시간의 1.9%에 의해 붕괴된다. 반감기는 301,200 년이며 자연적으로 미량 수량으로 찾을 수 있습니다.

플라스크에서 액체 염소. 크레딧 :WorkingClass91/Creative Commons
물리적 데이터
밀도 :
(가스) 0.002898 g/cm (끓는점에서의 액체) 1.5625 g/cm
용융점 : 171.6 K (-101.5 ° C, -150.7 ° F)
끓는점 : 239.11 K (-34.04 ° C, -29.27 ° F)
임계점 : 7.991 MPa at 416.9 K
20ºC의 상태 : 가스
융합의 열 : Cl 2 의 경우 6.406 kj/mol
기화의 열 : Cl 2 의 경우 20.41 kj/mol
어금니 열 용량 : Cl 2 의 경우 33.949 J/mol · K
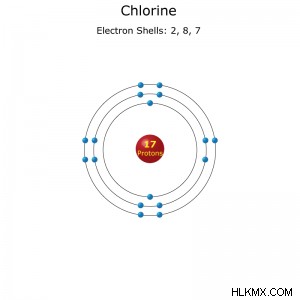
염소 원자의 전자 쉘 구성.
원자 데이터
원자 반경 : 1.75 Å
공유 반경 : 1.02 Å
van der waals 반경 : 1.75 Å
전자 친화력 : 348.575 kj/mol
전기 음성 : 3.16
1 이온화 에너지 : 1251.186 KJ/mol
2 이온화 에너지 : 2297.663 kj/mol
3 이온화 에너지 : 3821.78 kj/mol
4 이온화 에너지 : 5158.608 kj/mol
5 이온화 에너지 : 6541.7 kj/mol
6 이온화 에너지 : 9361.97 kj/mol
7 이온화 에너지 : 11018.221 kj/mol
8 이온화 에너지 : 33603.91 kj/mol
산화 상태 : +7, +5, +1, -1 (공통), +6, +6, +2 (드물지 않음)
재미있는 염소 사실
- 염소는 본질적으로 자유롭게 발생하지 않습니다. 다른 원소 (예 :테이블 소금 NaCl)와 함께 염소를 찾을 가능성이 훨씬 높습니다. .
- 염소는 지구의 바다에서 세 번째로 풍부한 요소입니다.
- 염소는 지구의 지각에서 21 번째로 풍부한 요소입니다.
- 염소는 인체에서 9 번째로 가장 풍부한 요소입니다.
- 염소 가스는 황록색과 강한 냄새가납니다.
- 염소의 냄새는 자극적입니다. 인간은 백만 분당 3.5 부의 낮은 농도의 냄새를 감지 할 수 있습니다.
- 염소는 초기 화학 무기였습니다. 그것은 점막과 반응하여 피부를 태울 수 있습니다. 백만 분당 약 1000 파트의 농도는 몇 번의 호흡 후에 일반적으로 치명적입니다. 염소 가스는 또한 공기보다 밀도가 높으며 트렌치 및 여우 홀과 같은 낮은 거짓말 부위에 정착합니다.
- 누출 염소 용기는 위험합니다. 용기의 누출은 암모니아를 사용하여 감지됩니다. 암모니아는 염소와 반응하여 누출 근처에 흰색 안개를 형성합니다.
- 염소는 유기 화학 반응에서 자주 나타나서 분자에서 수소 원자를 대체합니다.
- 염소는 플라스틱, 종이, 의약품, 살충제, 소독제, 섬유, 염료 및 석유 제품과 같은 다양한 제품의 제조에 사용됩니다. 소금물 용액으로부터의 전기 분해에 의해 상업적으로 추출된다.
- 염소의 Scheele의 이름은 Muriaticum이었습니다. 염산의 옛 이름은 Muriatic Acid입니다.
주기율표에서 요소에 대해 자세히 알아보십시오.