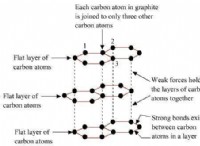
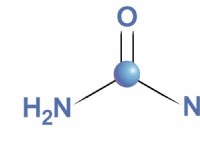
1. 둘 이상의 요소의 존재 :
* 화합물 고정 비율로 둘 이상의 다른 요소의 화학적 조합에 의해 형성된다.
* 요소 단일 대문자 또는 대문자와 소문자 (예 :H, O, NA, CL)로 표시됩니다.
* 공식에 둘 이상의 다른 요소에 대한 기호가있는 경우 화합물 일 수 있습니다.
예 :
* h₂o (물) :수소 (H) 및 산소 (O)를 함유합니다.
* naCl (테이블 소금 :나트륨 (NA)과 염소 (CL)를 함유합니다.
* co₂ (이산화탄소) :탄소 (C) 및 산소 (O)를 함유합니다.
2. 구역은 비율을 나타냅니다.
* 구독 화학적 공식에서는 화합물에 존재하는 각 요소의 원자 수를 나타냅니다.
* 첨자는 화합물의 요소의 비율을 나타냅니다.
예 :
* h₂o : 2 개의 수소 원자 (H at) 및 1 개의 산소 원자 (O).
* co₂ : 하나의 탄소 원자 (C) 및 2 개의 산소 원자 (O₂).
* c ₆h>o₆ (포도당) :6 개의 탄소 원자 (CAT), 12 개의 수소 원자 (HAT) 및 6 개의 산소 원자 (O₆).
중요한 참고 :
* 이러한 특징은 일반적으로 좋은 지표이지만 일부 물질은 공식으로 인해 화합물 인 것처럼 보일 수 있지만 실제로는 혼합물입니다. .
예 :
* 공기 질소 (NIT), 산소 (OAT) 및 이산화탄소 (COS)와 같은 가스의 혼합물입니다. 이 가스에는 개별 공식이 있지만 공기 자체에는 고정식이 없습니다.
따라서, 첨자로 표시된 고정 비율로 둘 이상의 요소가 존재하는 것은 화학적 공식을 통해 화합물을 식별하는 신뢰할 수있는 방법이다.