allotropy라는 용어는 고대 그리스어 단어에서 유래 한‘Allos’는‘기타’를 의미하고‘Tropos’는‘방식 또는 형태’를 나타냅니다. 그것은 화학 요소의 특성이 유사한 물리적 상태에서 다른 형태로 가변적으로 존재하는 것을 의미합니다. 동종 요소는 요소의 상이한 구조적 변화를 나타냅니다. 즉, 요소의 원자는 가변적 인 방식으로 함께 결합됩니다. 이것은 다이아몬드 (여기서 탄소 원자가 결정 격자 또는 사량 테라 드라) 흑연을 형성하기 위해 결합되어 (이에서, 탄소 원자가 육각형 격자 시트를 형성 함) (탄소 원자가 구면 또는 관형 구조를 형성하는) 흑연 (이에서는 탄소 원자가) 흑연 (이에서 탄소 원자가) 흑연 (이에서는 탄소 원자가) 흑연을 형성하기 위해 결합된다. 화합물이 아닌 만화물에서만 요소 만 고려됩니다. 다형성은 화합물을 고려하며 결정과 같은 고체 물질로만 제한됩니다. 유사한 물리적 상태 내에서 allotropy는 변수의 요소 형태를 나타냅니다. 몇몇 원소에서, 동종 트로프는 상이한 결정질 구조와 다른 분자 공식을 가지고 있으며, 물리적 상태의 차이는 또한 이산 소 O2 및 오존 O3과 같은 두 가지 상이한 산소의 산소에서도 고체, 액체 및 가스로 존재할 수있다. 동반 로프를 보여주는 원소에는 1841 년에 주석, 탄소, 인, 황 및 산소가 포함됩니다.
동종의 특성
-
allotropes는 다른 물리적 및 화학적 특성을 나타냅니다.
-
할당 형태의 변화는 빛, 압력 및 온도와 같은 다른 구조에 영향을 미치는 동일한 힘의 결과입니다.
-
다른 동종의 안정성은 일부 특정 조건에 따라 다릅니다.
-
동일한 요소의 동일한 요소는 탄소의 동반자, 즉 다이아몬드 및 흑연과 같은 다른 특성을 가지고 있습니다.
탄소 동종
탄소는주기적인 테이블의 요소 중 하나입니다. 탄소의 동종은 두 가지 형태로 분류됩니다.
-
비정질 탄소 동종
-
결정질 탄소 동종
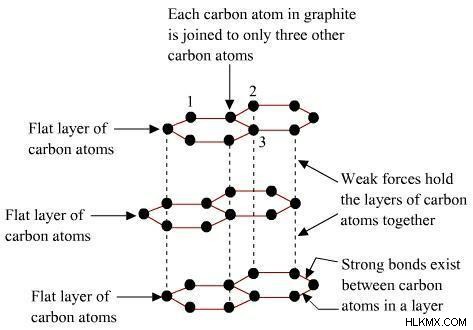
흑연
1789 년 아브라함 고트 랍 웨더 (Abraham Gottlob Wener)는 탄소의 가장 일반적인 할당수를 발견하여 흑연이라고 명명했습니다. 그것은 탄소의 가장 안정적이고 순수한 할당량입니다. 육각형으로 배열 된 탄소 원자의 평평한 2 차원 층을 포함한다. 그것은 부드럽고 검은 색과 미끄러운 토양으로 특징 지어집니다.
모든 층에서 단일 탄소 원자는 C-C 공유 결합의 도움으로 3 개의 다른 탄소 원자에 결합되며, 모든 탄소는 SP2 하이브리드 화됩니다. 나머지 네 번째 결합은 π- 결합으로 발생합니다. 이 π- 전자는 분비되므로 모바일이되어 전기를 수행하는 데 도움이됩니다. 일반적으로 흑연 α와 ß가 있습니다. α 형태는 제 1 층 위에 배치 된 제 3 층에 대해 일련의 ABAB로 배열 된 층을 갖는다. ß 형태로는 ABCABC 형식으로 배열됩니다.
-
다른 층 위의 완벽한 쌓기 때문에이 탄소의 배분은 윤활제로 작용할 수 있습니다.
-
흑연은 또한 전기를 수행하는 데 도움이되는 금속 광택제를 가지고 있으며, 흑연은 열과 전기의 좋은 도체입니다.
-
오일을 사용할 수없는 고온에서 흑연은 건조 윤활제로 사용됩니다.
-
산과 알칼리를 희석시키기위한 불활성의 특성을 가진 도가니를 만드는 데 사용할 수 있습니다.
-
흑연은 다이아몬드보다 열역학적으로 더 안정적입니다.
-
각 층은 탄소 원자의 평면 육각형 고리로 만들어집니다. 이 층은 Van der Waals의 매력을 통해 함께 유지됩니다.
-
흑연에서 시그마 본드 및 1 개의 탄소 형태의 pi-bond.
다이아몬드
가장 순수한 형태의 탄소입니다. 다이아몬드에서 탄소 원자는 얼굴 중심 입방 결정 구조의 회사의 격자에 배열된다. 다이아몬드는 원자 사이의 강한 공유 결합으로 인해 발생하는 많은 독특한 물리적 양을 가지고 있습니다. 각 상자 원자는 공유 및 4 개의 다른 탄소 원자에 대해 사면체로 결합된다. 이 사면체는 함께 의자 형태에 6 원 카본 고리의 3D 네트워크를 구성하여 제로 결합 각도 변형을 제공합니다. 이 3D 공유 결합 네트워크는 다이아몬드의 강한 강도의 주된 이유로 입증되었습니다.
다이아몬드의 특성 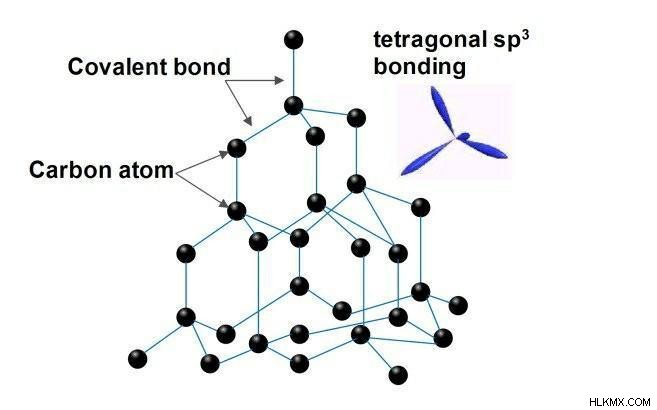
-
물질처럼 매우 단단하고 강합니다.
-
높은 용융점이 있습니다
-
그들은 높은 상대 밀도를 가지고 있으며 X- 선에 투명합니다.
-
다이아몬드는 굴절률의 값이 높습니다.
-
그것은 전기의 나쁜 지휘자이지만 열의 좋은 도체입니다.
-
그들은 대부분 모든 용매에 불용성입니다.
비정질 탄소
결정 구조가없는 탄소를 나타냅니다. 재료에 존재하는 SP2 대 SP3 혼성화 된 결합의 비는 비정질 탄소의 특성을 나타낸다. SP3 혼성화 된 결합이 풍부한 재료는 사면체 비정질 탄소 또는 탄소와 같은 다이아몬드로 알려져 있습니다.
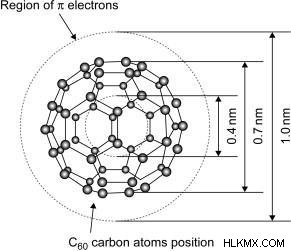
Fullerene
1985 년 Sussex University의 Harry Kroto 교수는 C60을 발견하고 그것을 Buckminsterfullerene으로 지명했습니다. 이 발견까지는 두 개의 탄소 동종이었다 :다이아몬드와 흑연. 20 개의 탄소 원자가 육각형으로 배열되고 그 중 12 개는 펜타곤으로 배열되는 60 개의 탄소 원자로 만들어진 구형 구조이며, 탄소 원자는 SP2 하이브리드 화된다. 그 모양은 축구와 비슷하기 때문에 때때로 '버키 볼'이라고도합니다. 그들은 분자간 힘과 낮은 융점을 가지고 있습니다. 전자 바다로 구성되어 전기를 전도하는 데 도움이됩니다. 그들은 유기 용매에 용해 될 수 있습니다.
결론
이 탄소 동반 시스템은 광범위한 사지를 가지고 있습니다. 다이아몬드에서와 같이 모든 탄소 원자를 함께 유지하는 결합은 매우 강하고 다이아몬드를 가장 어려운 반면,이 같은 결합은 흑연에서 약합니다. 다이아몬드에서 본드는 융통성이없고 3D 네트워크를 형성하는 반면, 채권은 육각형 시트를 형성하는 반면,이 시트는 서로 위로 미끄러 져 흑연을 부드럽게 만들 수 있습니다. 우리는이 기사가 다양한 동종의 탄소와 함께 할당과 그 특성에 대한 명확한 개념을 제공했기를 바랍니다.