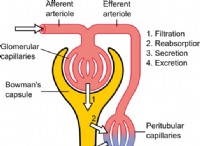
1. 100g 샘플을 가정하십시오
* 이것은 그램으로 직접 백분율을 만듭니다.
* 39.81 G Cu
* 20.06 g s
* (100-39.81-20.06) =40.13 g o
2. 그램을 두더지로 변환하십시오
* 각 요소의 질량을 어금니 질량으로 나눕니다.
* CU :39.81 g / 63.55 g / mol =0.627 mol
* S :20.06 g / 32.06 g / mol =0.626 mol
* O :40.13 g / 16.00 g / mol =2.51 mol
3. 가장 간단한 두더지 비율을 찾으십시오
* 각 두더지 값을 가장 작은 두더지 값 (0.626 mol)으로 나눕니다.
* Cu :0.627 mol / 0.626 mol ≈ 1
* S :0.626 mol / 0.626 mol ≈ 1
* O :2.51 mol / 0.626 mol ≈ 4
4. 경험적 공식
* 경험적 공식은 화합물에서 원자의 가장 간단한 전체 수비율을 나타냅니다. 따라서 경험적 공식은 쿠소 입니다 .
이것은 분자식 일 수 있습니까?
* 경험적 공식이 분자식 일 수도 있습니다. 그러나이를 확인하려면 더 많은 정보가 필요합니다. 분자식을 결정하기 위해서는 화합물의 몰 질량이 필요합니다.
이유는 다음과 같습니다.
* 경험적 공식은 원자의 가장 간단한 비율 만 알려줍니다.
* 분자식은 분자의 실제 원자 수를 나타냅니다.
예 :
* 화합물의 몰 질량이 159.61 g/mol이면, 분자식은 Cuso₄의 몰 질량이 159.61 g/mol이기 때문에 경험적 공식 (cuso₄)과 동일합니다.
그러나 화합물의 몰 질량이 319.22 g/mol이라면 분자식은 cu₂s₂o₈ (두 배의 경험적 공식) 일 것이다.