* 더 높은 비등점 : 염화 칼슘은 물에 용해되어 용액의 끓는점을 증가시키는 용질입니다. 이것은 물 분자와 용해 된 이온 사이의 분자간 힘이 증가했기 때문입니다.
* 하단 동결 지점 : 용액의 용해 된 이온은 얼음의 결정 격자 구조의 형성을 방해하여 동결 점을 더 낮게 만듭니다.
* 높은 삼투압 : 용해 된 이온의 존재는 삼투압을 증가 시키는데, 이는 반투과성 막을 가로 질러 물의 흐름을 방지하는 데 필요한 압력이다.
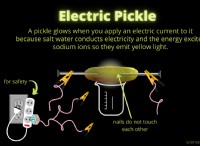
* 높은 전기 전도도 : 순수한 물은 전기가 열악하지만 염화 칼슘 용액의 용해 된 이온은 좋은 도체가됩니다.
요약하면, 염화 칼슘의 수용액은 끓는점, 낮은 동결 지점, 더 높은 삼투압 및 더 높은 전기 전도도를 갖는다. 순수한 물에 비해.