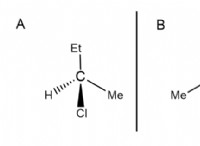
* 중화 반응 : HCl (강산)과 NaOH (강한 염기) 사이의 반응은 중화 반응이다. 방정식은 다음과 같습니다.
HCl (AQ) + NaOH (AQ) → NACL (AQ) + HATER (L)
* 반응물 소비 : 반응은 HCl 및 NaOH를 모두 소비하여 염화나트륨 (NaCl)과 물 (HATE)으로 전환시킨다.
* HCL 농도 감소 : 반응이 진행됨에 따라, 용액에서의 HCl의 양은 감소하여 농도가 더 낮다.
* 완전한 중화 : 반응이 모든 HCL이 NAOH와 반응 한 지점에 도달하면, 용액은 중화된다고한다. 이 시점에서, HCl의 농도는 효과적으로 0이 될 것이다.
중요한 참고 : 용액의 최종 농도는 HCl 및 NaOH의 초기 농도 및 반응의 화학량 론에 의존한다.