산화 :
* 정의 : 물질이 전자를 잃는 화학 공정 산화 상태가 증가합니다.
* 메커니즘 : 산소의 첨가뿐만 아니라 수소 제거 또는 다른 방식으로 전자의 손실을 포함 할 수 있습니다.
* 예 :
* 철의 녹음 (철분은 전자를 잃고 산소와 결합하여 산화철을 형성합니다)
* 연료 연소 (연료는 전자를 잃고 산소와 결합하여 에너지를 방출합니다)
* 목재 연소 (목재는 전자를 잃고 산소와 반응하여 재, 연기 및 열을 생성합니다)
산소화 :
* 정의 : 산소를 첨가하는 과정 분자 또는 물질로.
* 메커니즘 : 구체적으로 산소 원자의 직접 첨가를 포함한다.
* 예 :
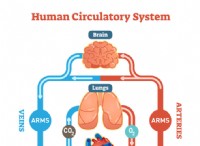
* 폐에서 혈액의 산소화 (산소 분자는 적혈구에서 헤모글로빈에 결합)
* 세포 호흡에서 포도당의 산화 (산소는 에너지를 위해 포도당을 분해하는 데 사용됩니다)
* 과산화수소를 형성하기 위해 물의 산소화 (표백 및 소독에 사용)
주요 차이점 :
* 초점 : 산화는 전자 손실 에 중점을 둡니다 산소화는 산소 첨가 에 중점을 둡니다 .
* 특이성 : 산소화는 특정 유형의 산화입니다. 모든 산화 반응이 산소를 포함하는 것은 아닙니다.
* 맥락 : 산소화는 종종 생물학적 및 생화학 적 맥락에서 사용되는 반면, 산화는 화학에 더 넓은 적용을 가지고있다.
간단한 용어로 :
다음과 같이 생각하십시오.
* 산화 : 물질은 잠재적으로 산소와 반응하여 전자를 "포기"하지만 항상 그런 것은 아닙니다.
* 산소화 : 물질은 산소를 직접 사용합니다.
일부 반응은 목재 연소와 같은 산화 및 산소화 일 수 있습니다.