주요 차이 - 과산화물 대 수퍼 옥사이드
산화물은 하나 이상의 산소 원자를 함유하는 화합물입니다. 산화물은 산화물 음이온 (O), 과산화물 음이온 (O)을 함유하는 과산화물 또는 과산화물 음이온을 함유하는 과산화물을 함유하는 산화물 일 수있다 (O 2 . ). 과산화물은 산소 산소 단일 결합으로 구성된 모든 화합물입니다. 이것은 음이온의 형태 또는 분자의 다른 원자 사이에있을 수 있습니다. 과산화수소는 발견 될 수있는 가장 간단한 과산화물입니다. 과산화물은 반응성이 높은 산소 원자로 구성됩니다. 과산화물은 알칼리 금속 (그룹 1 요소)에 의해서만 형성됩니다. 과산화물과 과산화물의 주요 차이점은 과산화물에서 산소의 산화 상태가 -1 인 반면, 과산화물의 산소 산화 상태는 -1/2입니다. .
주요 영역을 다루었습니다
1. 과산화수소
- 정의, 구조, 예
2. 과산화물이란 무엇입니까
- 정의, 구조, 예
3. 과산화수소와 과산화물의 차이점은 무엇입니까
- 주요 차이의 비교
주요 용어 :알칼리 금속, 알칼리성 지구 금속, 음이온, 결합 길이, 금속, 비금속, 산화물, 과산화물, 퍼 옥사이드 음이온, 퍼 옥소, 과산화물
과산화물
과산화물은 산소-산소 단일 결합으로 구성된 화합물입니다. 따라서, 과산화물 화합물을 식별하는 주요 특징은이 O-O 공유 결합의 존재이다. 때때로,이 결합은 이온 성 화합물에서 음이온으로 관찰 될 수있다. 그런 다음 기호로 o 2 로 제공됩니다 . 이것을 퍼 옥사이드 음이온 이라고합니다 . O-O 결합이 공유 화합물에서 발견되면 Peroxo Group 라고합니다. 또는 과산화물 그룹.
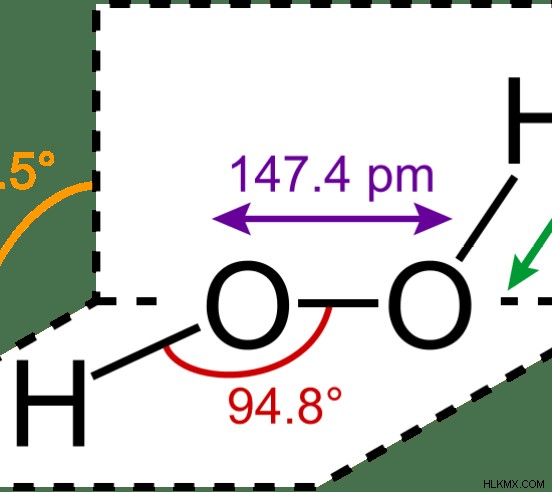
그림 1 :h 2 o 2 가장 간단한 과산화수 입니다
퍼 옥사이드 그룹에서 하나의 산소 원자의 산화 상태는 -1입니다. 일반적으로 산소는 산화 상태 0 또는 -2를 보여주는 것을 선호합니다. 그러나 2 개의 산소 원자가 서로 결합되기 때문에 하나의 산소 원자는 -1 산화 상태를 가져옵니다. 과산화물 음이온에서, 하나의 산소 원자는 음이온의 전체 전하가 -2이기 때문에 -1 전하를 갖는다.
이온 퍼 옥사이드는 양이온으로서 알칼리 금속 이온 또는 알칼리성 지구 금속 이온에 결합 된 과산화물 음이온으로 구성됩니다. 일부 예는 과산화나드 나트륨 (Na 2 입니다 o 2 ), 과산화 칼륨 (k <서브> 2 o 2 ), 과산화물 마그네슘 (MGO) 등 공유 퍼 옥사이드 화합물은 분자 내 다른 원자에 직접 결합 된 O-O 단일 결합으로 구성되어; 예를 들어, 과산화수소 (H <서브> 2 o 2 ) 및 퍼 옥시 모노 술로 산 (H 2 그래서
퍼 옥사이드는 생물학적 시스템과 본질적으로 찾을 수 있습니다. 예를 들어, 우리 세포의 일부 효소는 과산화물을 사용하여 특정 반응을 촉매합니다. 일부 식물 종은 과산화물 화합물을 신호 화학 물질로 사용합니다. 과산화물은 실험실 규모 응용에도 사용됩니다. 유기 반응으로부터 항 마르 코프 니코프 생성물을 얻기 위해 유기 화학에서 매우 유용합니다.
슈퍼 옥사이드
슈퍼 옥사이드는 음이온 o 2 를 함유하는 화합물입니다 . 과산화물 그룹에서, 하나의 산소 원자의 산화 상태는 -1/2이다. 일반적으로 산소는 산화 상태 0 또는 -2를 보여주는 것을 선호합니다. 그러나 두 개의 산소 원자가 서로 결합되기 때문에 하나의 산소 원자는 -1/2 산화 상태를 가져옵니다. 슈퍼 옥사이드 음이온에서 , 음이온의 전체 전하가 -1이기 때문에 하나의 산소 원자는 -1/2 전하를 갖는다.
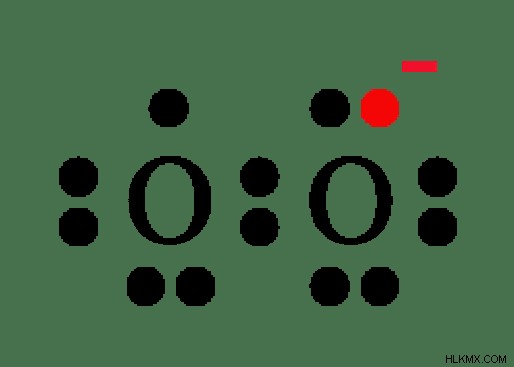
그림 2 :과산화물 음이온의 화학 구조
이 음이온은 O-O 단일 본드로 구성됩니다. -1/2 산화 상태가 안정적이지 않기 때문에 과산화물 음이온은 반응성이 높습니다. 과산화물 음이온은 상호 상자를 나타내는 자유 라디칼로 간주됩니다. 그것은 하나의 산소 원자에 짝을 이루지 않은 전자의 존재 때문입니다 (위의 이미지에 표시된 것처럼)
수퍼 옥사이드 음이온에서 O-O 결합의 결합 거리는 약 1.33a입니다. 알칼리 금속만이 과산화물 화합물을 형성하는 경향이 있습니다. 그들은 o 2 와 직접 반응을 통해 과산화물 화합물을 형성합니다. . 알칼리 금속의 과산화물은 NAO 2 를 포함한다 , ko 2 , rbo 2 및 CSO 2 . 여기서 금속에는 +1 전하가 있습니다. 이에 따라 음이온은 화합물을 중화시키기 위해 -1 전하를 가져야합니다.
이러한 과산화물 화합물이 물에 용해되면 시스템은 빠르게 불균형을 겪습니다. 불균형은 중간 산화 상태의 화합물이 2 개의 상이한 화합물로 전환되는 산화 환원 반응이다. 여기서, 과산화물 음이온 및 물은 반응하여 o 2 를 형성한다 그리고 오 이온.
4o 2 +2H 2 o → 3o 2 +4oh
이 반응은 우주 셔틀과 잠수함의 화학적 산소 생성기에서 산소 소스로 사용되는 이유입니다.
과산화물과 과산화물의 차이
정의
퍼 옥사이드 : 과산화물은 산소 산소 단일 결합으로 구성된 화합물입니다.
과산화물 : 과산화물은 음이온 O 2 를 함유하는 화합물이다 .
화학식
퍼 옥사이드 : 과산화물 음이온의 화학적 공식은 O 2 이다 .
과산화물 : 과산화물 음이온의 화학적 공식은 O 2 이다 .
전하
퍼 옥사이드 : 퍼 옥사이드 이온의 전하는 -2.
이다과산화물 : 과산화물 이온의 전하는 -1.
이다본드 길이
퍼 옥사이드 : 과산화물 이온의 O-O 결합 길이는 1.49 ° a.
이다과산화물 : 과산화물 이온의 O-O 결합 길이는 1.33 ° a.
이다자연
퍼 옥사이드 : 금속 (예 :알칼리 금속) 및 비금속 (예 :수소)은 과산화물 화합물을 형성 할 수 있습니다.
과산화물 : 알칼리 금속만이 과산화물 화합물을 형성 할 수 있습니다.
예제
퍼 옥사이드 : 과산화물 화합물에 대한 예는 Na2O
과산화물 : 과산화물 화합물에 대한 예는 NAO <서브> 2 을 포함한다 , ko 2 , rbo 2 및 CSO 2.
결론
퍼 옥사이드와 과산화물은 산소를 함유 한 산화물입니다. 과산화수소와 과산화물의 주요 차이점은 과산화물에서 산소의 산화 상태가 -1 인 반면, 과산화물의 산소 산화 상태는 -1/2이라는 것이다.
참조 :
1.“12.4 :과산화물과 과산화물.” Chemistry LibreTexts, LibreTexts, 2016 년 7 월 21 일, 여기에서 구할 수 있습니다.
2.“Superoxide.” Wikipedia, Wikimedia Foundation, 2017 년 12 월 15 일, 여기에서 avialable.
이미지 제공 :
1. SVG에 의한“H2O2 가스 구조”:Sassospicco; Raster :Walkerma - 파일 :Commons Wikimedia
2를 통한 H2O2 구조 .png (GFDL). Commons Wikimedia