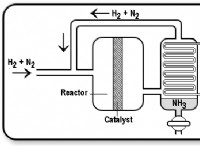
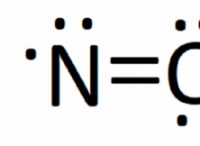* S- 블록 요소 : 이 요소는 주기율표의 처음 두 열에 있습니다 (그룹 1 및 2). 그것들은 각각 하나 또는 두 개의 원자가 전자를 갖는 것이 특징입니다.
* hydrides : 이들은 요소와 수소의 조합에 의해 형성된 화합물이다.
* 공유 결합 : 이러한 유형의 결합은 원자 사이의 전자 공유를 포함합니다.
* 중합체 구조 : 이것은 동일한 분자의 반복 단위가 서로 연결되는 사슬 형 구조를 나타냅니다.
왜 S- 블록 히드 라이드가 공유 중합체를 형성하지 않는지 :
* 전기 양성 : S- 블록 요소는 전기성이 매우 높기 때문에 전자와 형태 양이온을 잃는 경향이 있습니다. 이것은 공유 결합보다는 수소와 이온 결합을 형성 할 가능성이 더 높습니다.
* 이온 성격 : S- 블록 수 소화물은 본질적으로 이온 성이다. 예를 들어, Lih, Nah 및 CAH2는 정전기력에 의해 함께 유지되는 금속 양이온 및 수 소화물 음이온을 갖는 이온 수 소화물이다.
* 금속 결합 : 더 무거운 알칼리 금속 (K, RB, CS)과 같은 일부 S- 블록 수 소화물은 금속 결합을 나타낼 수 있지만 공유 중합은 아닙니다.
S- 블록 수 소화물의 예 :
* lih (리튬 수 소화물) - 이온
* nah (수 소음) - 이온
* cah2 (칼슘 수 소화면) - 이온
* kh (수 문장) - 이온 성 특성을 가진 금속성
* rbh (Rubidium Hydride) - 이온 성 특성을 가진 금속성
결론 :
S- 블록 수 소화물은 주로 공유가 아닌 본질적으로 이온 성 또는 금속성이다. 그들은 공유 중합체 구조를 형성하지 않습니다.