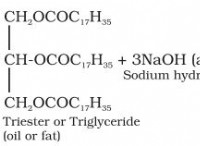산화 수 이해 :
* 이온 성 화합물 : 이온의 전하가 명확하게 정의되기 때문에 산화 수는 이온 성 화합물에 쉽게 할당됩니다. 예를 들어, NaCl에서, 나트륨 (NA)의 산화 수는 +1이고 염소 (CL)의 산화 수는 -1입니다.
* 공유 화합물 : 공유 화합물에서, 전자는 원자 사이에 공유되며, 완전히 전달되지는 않았다. 이것은 "전하"의 개념이 명확하지 않다는 것을 의미합니다.
공유 분자에서 산화 수 할당 :
"전하"의 개념은 공유 결합에서 명확하지 않지만, 우리는 여전히 다음 규칙을 사용하여 산화 숫자를 할당 할 수 있습니다.
1. 전기 음성 : 공유 결합에서 더 전기 음성 원자는 음의 산화 수가 할당되는 반면, 전기 음성 원자는 양의 산화 수가 할당된다. 전기 음성 성은 원자가 전자를 유치하는 경향의 척도입니다.
2. 그룹 규칙 : 특정 요소 그룹은 종종 특정 산화 수를 갖습니다.
* 그룹 1 금속 (Li, NA, K 등)은 항상 +1 을가집니다.
* 그룹 2 금속 (BE, MG, CA 등)은 항상 +2 를가집니다.
* 불소 (F)는 항상 -1 을가집니다.
* 산소 (O)는 일반적으로 -1을 가진 퍼 옥사이드 (O2^-2)를 제외하고 -2 를가집니다.
* 수소 (H)는 일반적으로 금속 수 소화물 (예 :NAH)을 제외하고 +1 을가집니다.
3. 산화 수의 합 : 분자의 모든 산화 수의 합은 0과 같아야합니다. 다 원자 이온에서 합은 이온의 전하와 동일해야합니다.
예 :
분자 수 (H2O)를 고려하십시오.
* 산소는 수소보다 전기 음성이므로 -2 산화 수가 할당됩니다.
* 2 개의 수소 원자가 각각 +1로 할당됩니다.
* 산화 번호 (+1 +1 -2)의 합은 0이며 규칙을 충족합니다.
중요한 참고 :
* 공유 분자의 산화 수는 화학 반응을 이해하고 예측하는 데 유용한 도구이지만, 원자에 대한 실제 전하를 반영하지는 않습니다.
* "공식 전하"라는 개념은 때때로 공유 결합에서 전자 분포에 대한보다 정확한 그림을 제공하는 데 사용됩니다.
요약하면, 공유 분자는 이온 성 화합물과 같은 고정 전하가 없지만 전기 음성 및 기타 규칙에 따라 여전히 산화 수를 할당 할 수 있습니다. 이를 통해 상대적인 전자 분포를 이해하고 공유 화합물의 반응성을 예측할 수 있습니다.