Raoult의 법칙은 용매의 증기압 및 용매의 몰 분율에 기초하여 비 휘발성 용질을 사용한 이상적인 용액의 증기압을 결정하는 데 사용됩니다. 아래에서 우리는 Raoult 법의 방정식이 무엇인지 논의하고, 법이 어떻게 작동하는지에 대한 설명으로 뛰어 들고, 몇 가지 예를 공유합니다.
.Raoult 's Law Requation
비 휘발성 용질에 대한 Raoult의 법에 대한 방정식은 다음과 같습니다.

- p soln 용액의 증기 압력입니다.
- p solv 용액이 측정되는 것과 동일한 온도에서 용매의 증기 압력입니다.
- x solv 용액에서 용매의 두더지 분율입니다.
Raoult의 법률 설명
Raoult의 법칙은 용액의 증기 압력을 결정하기 위해 비 휘발성 용질이있는 솔루션과 함께 사용됩니다. 용액의 증기압은 용액에서 순수한 용매의 증기압 및 용매의 몰 분율에 의존한다.
.용액의 용질량이 증가함에 따라 용액의 증기압이 감소합니다. 증기 압력의 절대 값은 용매의 원래 증기 압력에 따라 다릅니다.

이 공식은 이상적인 솔루션 및 비 휘발성 용질에 가장 적합합니다. 비 휘발성 용질은 증발하는 경향이 없습니다. 예를 들어, 바닷물에 소금. 물이 증발 할 때 소금 뒤에 남겨 둡니다.
두더지 분획을 결정하는 방법에 대한 새로 고침은이 기사를 참조하십시오. 간단히 말해서, 용매의 몰 분율은 용매의 두부를 용액의 총 두더지로 나눈다.

Raoult 법의 제한
Raoult의 법칙은 모든 상황에서 완벽하게 작동하지는 않습니다. 다음은 법의 두 가지 주요 한계입니다.
이상적인 솔루션 - 솔루션은 Raoult의 법률이 적용하기위한 이상적인 솔루션이어야합니다. 이상적인 솔루션은 매우 집중되지 않았거나 매우 희석되지 않습니다. 이상적인 용액을 위해 용매 분자 사이에 있었기 때문에 용질과 용매 사이에 유사한 분자간 힘이 있어야합니다.
용질의 두부 - 용질이 용액에 해리되는 경우 고려해야합니다. 예를 들어, NaCl (염)이 물에 첨가되면 Na 및 Cl로 분리됩니다. 이들은 NaCl의 두더지보다 두 배의 용질 용질의 두 배나 작용할 것이다. 이것은 고려해야합니다.
왜이 효과가 발생합니까?
용질 농도가 증가함에 따라 증기압 감소는 표면의 분자에 기인한다. 그것이 순수한 용매 일 때, 표면의 모든 분자는 용매 분자이다. 이 표면 분자는 또한 증기 상으로 분리 될 것입니다. 용질 농도가 증가함에 따라, 표면에 용매 분자가 적어 증기 상으로 빠져 나옵니다. 이러한 표면 반점 중 일부는 이제 용질 분자에 의해 점유됩니다. 이것은 전체 증기 압력을 감소시킵니다.

예제 프로브 lem
예제 문제 :
25C에서 에탄올 용액을 고려하십시오. 200 그램의 에탄올 (46.07 g/mol)에 25 그램의 자당 (342.3 g/mol)을 추가합니다. 에탄올에 대한 최초의 증기압은 44 Torr였다. 25C에서 에탄올 및 수 크로스 용액의 새로운 증기압은 무엇입니까?
작업 예제 솔루션 :
이 예에서 우리의 용매는 에탄올이고 우리의 용질은 수 크로스입니다. Raoult의 방정식을 기반으로 새로운 증기 압력을 결정하기 위해 용매의 원래 증기 압력과 용매의 새로운 두더지 분율을 알아야합니다.

이 질문은 원래 증기 압력, p solv 를 알려줍니다 ,, 44 Torr입니다. 우리가 필요로하는 유일한 변수는 용매의 두더지 분율, x solv 입니다. .
용매의 두더지 분율을 찾으려면 먼저 자당 그램과 에탄올 그램을 두더지로 변환해야합니다.

그런 다음 우리는 용매의 두더지 분율을 해결할 수 있습니다.
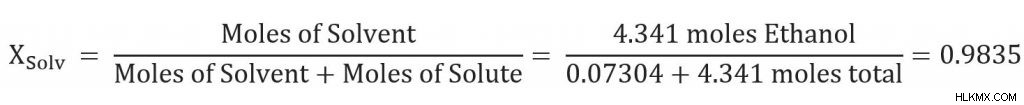
이제 우리는 필요한 모든 변수를 가지고 있으며 Raoult의 법률 방정식에 연결할 수 있습니다.

마지막 답변은 43.27 Torr의 증기 압력으로 나옵니다. 용액의 용질으로 인해 압력이 0.73 토르로 낮아집니다.
Raoult의 법칙을 관찰하는 실험적인 방법
Raoult의 법칙을 관찰하기 위해 할 수있는 몇 가지 실험이 있습니다!
먼저, 순수한 용매의 비이커의 증발 속도를 동일한 용매로 만든 용액의 비이커와 비교할 수 있습니다. 두 비이커 모두 전체 용액의 전체 솔루션을 가지고 있는지 확인하십시오. 하루 정도 앉을 수있게 된 후에는이 둘 사이에 부피가 눈에 띄게 차이가있을 것입니다. 순수한 용매는 증기 압력이 높기 때문에 더 빨리 증발합니다.
Raoult의 법칙을 관찰하는 두 번째 방법은 압력계를 사용하는 것입니다. 압력계는 수은이있는 U 자형 튜브에 연결되는 닫힌 컨테이너입니다. 튜브의 다른 쪽 끝은 대기에 개방되어 있습니다. 순수 용매와 용액의 증기압을 측정 할 수 있습니다.








