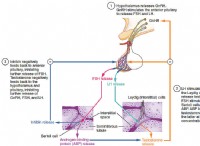
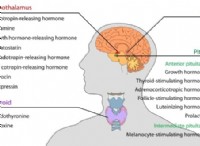
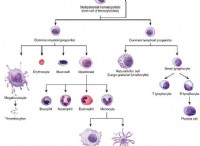
1. 균형 화학 방정식을 작성하십시오 :
BA (OH)) (aq) + 2HCL (aq) → BACL₂ (aq) + 2H₂O (L)
2. 필요한 HCL의 두더지를 결정하십시오 :
균형 방정식에서, 우리는 1 몰의 Ba (OH) ₂가 2 몰의 HCl과 반응한다는 것을 알 수있다. 그러므로:
* HCl의 두더지 =0.333 mol ba (OH) ₂ * (2 mol HCl / 1 mol ba (OH) ₂ ₂) =0.666 mol HCl
3. HCL 용액의 부피를 계산하십시오 :
HCL 솔루션의 Molarity (M)를 사용하여 볼륨을 찾을 수 있습니다.
* Molarity (m) =Moles (mol) / 부피 (L)
* 부피 (l) =두더지 (mol) / Molarity (m)
* 부피 (l) =0.666 mol / 5.00 m =0.133 l
답 : 0.133 리터가 필요합니다 0.333 mol의 수산화 바륨을 중화시키기위한 5.00 m hindrochlorr를 중화시킨다.