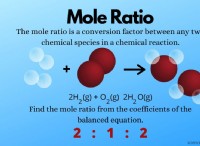
1. 반응물의 고갈 :
* 반응은 반응물을 진행해야합니다. 하나 이상의 반응물이 완전히 소비되면 반응이 중단됩니다.
* 케이크를 굽는 것을 상상해보십시오. 밀가루가 부족하면 설탕이나 계란이 얼마나 있더라도 더 이상 반죽을 만들 수 없습니다.
2. 평형 :
* 많은 반응이 가역적이므로 제품이 반응물을 다시 형성하기 위해 반응 할 수 있습니다. 결국, 순방향 반응의 속도 (생성물에 반응) 및 역 반응의 속도 (반응물에 대한 생성물)는 동일하게된다. 이 상태를 평형이라고합니다.
* 평형에서 반응은 중지 된 것으로 보이지만 실제로는 여전히 양방향으로 동일한 속도로 계속되고 있습니다.
3. 에너지 부족 :
* 일부 반응은 진행하기 위해 에너지 입력이 필요합니다 (흡열 반응). 이 에너지가 제공되지 않으면 반응이 중지됩니다.
* 좋은 예는 요리입니다. 재료가 반응하고 요리 된 식사로 갈아 입기 위해 스토브에서 열이 필요합니다.
4. 불리한 조건 :
* 온도, 압력 및 pH는 반응의 속도와 방향에 영향을 줄 수 있습니다.
예를 들어, 일부 반응은 진행하기 위해 고온이 필요하지만 다른 반응은 저온으로 선호됩니다.
5. 억제 :
* 특정 물질은 반응이 느려지거나 완전히 중단 될 수 있습니다. 이를 억제제라고합니다.
예를 들어, 우리 몸의 효소는 특정 분자에 의해 억제 될 수있어 특정 반응을 촉진하는 것을 방지합니다.
6. 촉매 비활성화 :
* 촉매제는 소비하지 않고 반응 속도를 높입니다. 그러나 중독이나 다른 과정을 통해 시간이 지남에 따라 비활성화 될 수 있습니다.
* 촉매가 더 이상 활성화되지 않으면 반응이 느려지거나 멈 춥니 다.
7. 부작용 :
* 바람직하지 않은 부산물의 형성에 의해 반응이 전환 될 수있다.
* 이것은 반응물을 소비하거나 주요 반응을 방해하는 조건을 만들 수 있습니다.
8. 불완전한 혼합 :
* 반응이 발생하려면 반응물이 접촉해야합니다. 혼합물이 불완전하거나 고르지 않으면 반응이 완전히 진행되지 않을 수 있습니다.
9. 표면적 :
* 고체와 관련된 반응의 경우, 반응물에 노출 된 표면적이 중요하다. 고체가 큰 덩어리 인 경우 반응이 느리거나 불완전 할 수 있습니다.
이것이 화학 반응이 멈출 수있는 이유 중 일부일 뿐이라는 것을 기억하는 것이 중요합니다. 반응에 영향을 미치는 특정 요인은 관련된 특정 화학 시스템에 의존합니다.