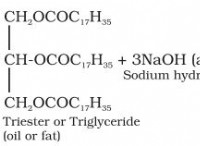이유는 다음과 같습니다.
* 거대한 구조 공유 결합 원자의 연속 네트워크로 특징 지어지며, 재료 전체에 걸쳐 확장된다. 예로는 다이아몬드와 이산화 실리콘이 있습니다.
* 이온 격자 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 염화나트륨에서, 나트륨 이온 (Na+) 및 클로라이드 이온 (Cl-)은 규칙적이고 반복되는 패턴으로 배열되어 3 차원 격자를 형성한다.
이온 격자의 주요 특성 :
* 강한 정전기력 : 반대로 하전 된 이온 사이의 매력은 매우 강해서 녹는 점과 비등점이 높습니다.
* 부서지기 : 구조의 작은 이동이 정전기 균형을 방해 할 수 있기 때문에 정기적 인 이온 배열은 격자를 취성하게 만듭니다.
* 은 용융 될 때 또는 용액에서 전기를 수행합니다 : 이온은 고체가 녹거나 물에 용해 될 때 자유롭게 움직이고 충전 할 수 있습니다.
따라서 염화나트륨은 고도로 정렬 된 구조를 가지고 있지만, 관련된 채권의 특성으로 인해 거대한 구조로 간주되지 않습니다.