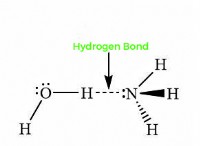
공유 결합
* 공유는 돌보고 있습니다 : 원자는 전자를 공유하여 안정적인 전자 구성을 달성합니다 (일반적으로 고귀한 가스와 비슷 함).
* 비금속 : 공유 결합은 전형적으로 비금속 사이 (주기성 표의 오른쪽에있는 요소) 사이에 형성됩니다.
* 동등한 공유 (비극성) 또는 불평등 공유 (극) :
* 비극성 공유 : 전자는 원자 사이에 동일하게 공유되어 균형 잡힌 전하 분포를 초래합니다.
* 극성 공유 : 전자는 불평등하게 공유되어 하나의 원자에 약간의 양전하가 있고 다른 원자에는 약간의 음전하가 발생합니다.
* 이온 결합보다 약한 : 공유 결합은 일반적으로 이온 성 화합물보다 용융점 및 비등점이 더 낮습니다.
* 예 : 물 (H₂O), 메탄 (ch₄), 이산화탄소 (Co₂)
이온 결합
* 주고 받으십시오 : 하나의 원자 (일반적으로 금속) *는 * 전자를 기증하여 양으로 하전 된 이온 (양이온)이됩니다. 다른 원자 (보통 비금속) *는 * 전자를 받아 들여 음이온 (음이온)이됩니다. 반대의 청구는 유인하여 채권을 형성합니다.
* 금속 및 비금속 : 이온 결합은 일반적으로 금속 (주기 테이블의 왼쪽)과 비금속 사이에 형성됩니다.
* 강력한 명소 : 반대로 하전 된 이온 사이의 정전기 인력은 매우 강합니다.
* 높은 용융 및 끓는점 : 이온 성 화합물은 강한 정전기력으로 인해 높은 용융 및 끓는점이 있습니다.
* 예 : 테이블 소금 (NaCl), 염화 칼슘 (CaCl₂), 산화 마그네슘 (MGO)
주요 차이점을 요약하는 데 유용한 테이블이 있습니다 :
| 기능 | 공유 결합 | 이온 결합 |
| --- | --- | --- |
| 전자 공유/전송 | 공유 | 전송 |
| 원자 유형 | 비금속 | 금속 및 비금속 |
| 결합 강도 | 약한 | 더 강한 |
| 용융/비등 지점 | 더 낮은 | 더 높은 |
| 예 | 물 (H₂O), 메탄 (ch₄) | 테이블 소금 (NaCl), 염화 칼슘 (Cacl₂) |
기억하십시오 :
*이 일반적인 규칙에는 예외가 있으며 일부 화합물에는 공유 및 이온 결합의 특성이 있습니다.
* 결합의 유형은 용융점, 끓는점 및 용해도와 같은 물질의 특성에 영향을 줄 수 있습니다.