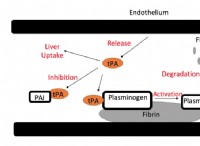
이해 Q와 K
* 평형 상수 (k) : K는 평형에서 반응물 대 제품 대 반응물의 비율을 나타낸다. 특정 온도에서 주어진 반응에 대한 고정 값입니다.
* 반응 지수 (Q) : Q는 주어진 순간에 반응물과의 비율의 비율을 반드시 평형을 이루는 것과 같습니다.
시기 Q> K
Q가 K보다 클 때, 평형에 존재하는 것과 비교하여 반응물에 비해 더 높은 농도의 생성물이 있음을 의미합니다. 시스템은 평형이 아니다 .
교대
평형에 도달하기 위해 반응은 왼쪽으로 이동합니다. , 역 반응을 선호합니다 . 이것은 다음을 의미합니다.
* 제품은 소비됩니다 : 시스템은 일부 제품을 다시 반응물로 변환합니다.
* 반응물이 형성 될 것이다 : 반응물의 농도가 증가합니다.
왜 변화가 일어나는가
반응은 왼쪽으로 이동하여 과도한 제품으로 인한 "스트레스"를 완화시킵니다. 한쪽이 무겁다면 (더 많은 제품), 반응이 더 가벼운 쪽 (더 많은 반응물)으로 이동하여 사물의 균형을 잡을 것입니다.
예
A와 B가 C와 D를 형성하여 반응하는 반응을 상상해보십시오.
a + b + c + d
* q> k : 인 경우 평형보다 더 많은 C와 D가 있습니다. 반응은 왼쪽으로 이동하여 C와 D를 소비하고 A 및 B를 생성합니다.
키 테이크 아웃
Q> K 일 때, 반응은 반응물을 향해 이동하여 평형에 도달한다.