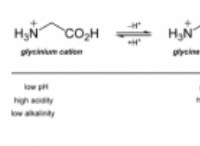
* 끓는점 이해 : 끓는점은 액체가 가스로 변하는 온도입니다. 더 강한 분자간 힘은 더 높은 끓는점으로 이어집니다.
* 분자간 힘 :
* 수소 결합 : 산소, 질소 또는 불소와 같은 고도로 전기 음성 원자에 결합 된 수소가있는 분자에 존재하는 가장 강한 유형의 분자간 힘.
* 쌍극자 쌍극자 상호 작용 : 극성 분자 사이에서 발생합니다.
* 런던 분산 세력 : 모든 분자에 존재하지만 분자 크기가 증가함에 따라 가장 약한 힘.
화합물 분석 :
* nh3 (암모니아) : N-H 결합으로 인해 수소 결합이 있습니다.
* HCl (염화 수소) : 극성으로 인해 쌍극자-쌍극자 상호 작용이 있습니다.
* H2 (수소) : 런던 분산 세력이 약한 것만으로도 약합니다.
* ki (요오드화 칼륨) : 이것은 이온 성 화합물이며, 이는 고체 상태에서 이온으로 존재한다는 것을 의미합니다. 이온 성 힘은 매우 강해서 녹는 점과 끓는점이 매우 높습니다.
결론 :
* ki (요오드화 칼륨) 강한 이온 성 힘으로 인해 가장 높은 끓는점을 가질 것입니다.
중요한 참고 : 수소 결합은 강한 분자간 힘이지만 이온 결합은 더욱 강합니다.