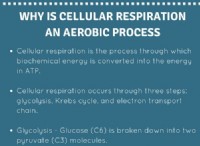
1. 반 반응을 식별하십시오
* 산화 : cri₄ → cro₃²⁻ + io₄⁻ (크롬과 요오드가 산화되고 있습니다)
* 감소 : cl₂ → cl⁻ (염소가 감소하고 있습니다)
2. 균형 원자 (H 및 O 제외)
* 산화 : cri₄ → cro₃²⁻ + 3io₄⁻
* 감소 : cl₂ → 2Cl 2
3. 균형 산소 원자
* 산화 : cri₂ + 16h 16o → cro₄²⁻ + 3io₄⁻
* 감소 : (균형을 잡을 산소 없음)
4. 균형 수소 원자
* 산화 : cri₂ + 16h 16o → cro₄²⁻ + 3io₄⁻ + 28h⁺
* 감소 : (균형을 잡을 수소 없음)
5. 잔액 요금
* 산화 : cri₂ + 16h 16o → cro₄²⁻ + 3io₄⁻ + 28h⁺ + 27e⁻
* 감소 : cl₂ + 2e⁻ → 2cl⁻
6. 전자 균등화
* 반 반응을 27/2로 곱하여 양쪽에 27 개의 전자를 얻습니다.
* 산화 : cri₂ + 16h 16o → cro₄²⁻ + 3io₄⁻ + 28h⁺ + 27e⁻
* 감소 : 27/2 CL 27 + 27E⁻ → 27CL⁻
7. 반 반응을 결합하십시오
cri₂ + 16h 16o + 27/2 cl₂ → cro₄²⁻ + 3io₄⁻ + 28h⁺ + 27cl⁻
8. h⁺ 이온을 중화시키기 위해 OH 이온을 추가하십시오
* 우리는 기본 솔루션에 있기 때문에 방정식의 양쪽에 28 OH⁻를 추가하십시오.
* cri₃ + 16h₃o + 27/2 cl₂ + 28oh⁻ → cro₄²⁻ + 3io₄⁻ + 28h⁺ + 27cl⁻ + 28oh⁻
* 이것은 물을 형성하기 위해 결합합니다.
* cri₃ + 16h₃o + 27/2 cl₂ + 28oh⁻ → cro₄²⁻ + 3io₄⁻ + 28h₂o + 27cl⁻
9. 단순화
* 양쪽에서 16HOO를 취소하십시오.
* cri₃ + 27/2 cl₂ + 28oh⁻ → cro₄²⁻ + 3io₄⁻ + 12h₂o + 27cl⁻
기본 솔루션에서 균형 된 산화 환원 반응 :
cri₂ + 27/2 cl₂ + 28oh⁻ → cro₄²⁻ + 3io₄⁻ + 12h₂o + 27cl⁻
중요한 참고 : 전체 방정식에 2를 곱하여 분수를 제거 할 수 있습니다.
2CRI₃ + 27CL₃ + 56OH⁻ → 2CRO₄²⁻ + 6IO₄⁻ + 24HALO + 54CL⁻