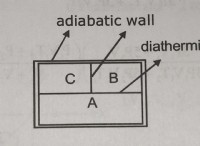
* 이온화 에너지 : 기체 상태의 원자에서 하나의 전자를 제거하는 데 필요한 최소 에너지량.
* 비금속 : 주기율표의 오른쪽에 위치한 요소 (고귀한 가스 제외). 그들은 일반적으로 전기 음성이 높고 전자를 얻는 경향이 있습니다.
비금속은 일반적으로 금속보다 첫 번째 이온화 에너지가 더 높습니다. 이것은 다음과 같습니다.
* 더 강한 핵 매력 : 비금속은 원자 반경이 작고 더 큰 효과적인 핵 전하를 갖는다 (가장 바깥 쪽 전자에 의해 펠트 펠트). 이 강력한 매력은 전자를 제거하기가 더 어렵습니다.
* 안정적인 전자 구성 : 비금속에는 종종 거의 외부 전자 쉘이 있습니다. 전자를 제거하면 이러한 안정성이 방해되어 더 많은 에너지가 필요합니다.
예 :
* 염소 (CL) : 1251 kJ/mol의 제 1 이온화 에너지를 갖는 비금속. 이 높은 값은 핵과 가장 바깥 전자 사이의 강력한 매력을 반영합니다.
키 포인트 :
* 첫 번째 이온화 에너지는 일반적으로 주기율표의 왼쪽에서 오른쪽으로 이동할 때 일반적으로 증가합니다.
* 첫 번째 이온화 에너지는 일반적으로 주기율표의 그룹 (위에서 아래로)을 아래로 이동함에 따라 감소합니다.
따라서, 비금속의 첫 번째 이온화 에너지를 나타내는 값은 금속의 이온화 에너지에 비해 상대적으로 높은 수가 될 것이다. .