산-염기 적정 대 산화 환원 적정 :주요 차이점
산-염기 적정 및 산화 환원 적정은 모두 알려지지 않은 용액의 농도를 결정하는 데 사용되는 분석 기술이지만, 기본 원리 및 응용 분야에서 크게 다릅니다.
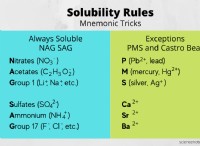
산-염기 적정 :
* 원리 : 산과 염기 사이의 중화 반응에 기초합니다.
* 반응 : 산으로부터의 H+ 이온은 염기로부터의 오온과 반응하여 물을 형성한다 (H2O).
* 표시기 : 적정의 종말점을 시각적으로 신호하며, 일반적으로 중성 pH에서 색상을 변화시킵니다.
* 예 : 수산화 나트륨의 표준화 된 용액을 사용하여 식초 용액 (아세트산)의 농도를 결정합니다.
산화 환원 적정 :
* 원리 : 두 반응물 사이의 전자의 전달에 기초한다.
* 반응 : 하나의 반응물은 산화되고 (전자 손실), 다른 반응물은 감소된다 (전자 게인).
* 표시기 : 용액의 산화 환원 전위에 따라 색상을 변화시키는 자체 표시기 (반응체 변화 색상) 또는 산화 환원 지표 일 수 있습니다.
* 예 : 칼륨 과망간산 칼륨의 표준화 된 용액을 사용하여 철 (II) 용액의 농도를 결정합니다.
주요 차이점 :
| 기능 | 산베이스 적정 | 산화 환원 적정 |
|--------------------|----------------------------|---------------------------|
| 원리 | 중화 | 전자 전송 |
| 반응 유형 | 산베이스 | 산화 환원 |
| 표시기 | pH 감도 | 산화 환원 잠재적 민감성 |
| 일반적인 예 | 산 농도, 염기 농도 | 산화제 또는 환원제의 농도 |
| 응용 | 식품 화학, 환경 분석 | 야금, 수질 분석 |
요약 :
산- 염기 적정은 산 및 염기의 농도를 결정하기 위해 H+ 및 OH 이온의 반응에 의존한다. 산화 환원 적정은 전자 전달 반응에 중점을 두어 산화제 및 환원제를 분석하는 데 유용합니다. 그것들은 분석 화학에서 다른 목적을 달성하는 뚜렷한 기술입니다.