
용해도 규칙 화학에서는 실온 근처의 물에 용해되는 무기 화합물을 식별하기위한 일련의 지침이 있습니다.
용해도 가란?
용해도 물질이 용매를 형성하기 위해 용매에 얼마나 쉽게 용해 되는가입니다. 용해 물질은 용질입니다. 그것이 용해되는 화학 물질을 용매라고합니다.
가용성 화학 물질은 어떤 비율로든 용매에 자유롭게 용해됩니다. 예를 들어, 에탄올은 물에 용해됩니다. 불용성 화학 물질은 용매에 용해되지 않습니다. 그러나 용해도는 전적으로 또는 전혀없는 과정이 아닙니다. 많은 화학 물질은 약간 용해되므로 완전히 녹지는 않지만 부분적으로 이온에 분리됩니다. 많은 "불용성"화학 물질은 여전히 용매에 매우 약간 용해되므로 물질의 작은 부분이 용해됩니다.
용해도 규칙은 무엇입니까?
용해도 규칙은 실온에서 또는 근처의 물에서 무기 화합물의 용해도를 예측하는 일련의 지침입니다. 가용성 화합물은 수용액을 형성합니다.
| 가용성 화합물 | 예외 (불용성) |
| 알칼리 금속 화합물 (Li, NA, K, RB, CS) | |
| 암모늄 이온 화합물 (NH 4 ) | |
| 질산염 (no 3 ), 중탄산염 (hco 3 ), 염소산염 (clo 3 ) | |
| 아세테이트 (c 2 H 3 o 2 ) | |
| Halides (CL, BR, I) | Ag, HG, PB의 할로이드 (가용성 AGF 제외) |
| 설페이트 (so 4 ) | Ag, CA, SR, BA, HG, PB 의 황산염
| 불용성 화합물 | 예외 (가용성) |
| 탄산염 (Co 3 ), 인산염 (po 4 ), 크로마이트 (cro 4 ) | 알칼리 금속 화합물 (Li, NA, K) 및 암모늄 이온을 함유하는 것 (NH <서브> 4 ) |
| hydroxides (OH), 황화물 (S) | 알칼리 금속 화합물 및 Ca, Sr, Ba | 를 함유하는 것
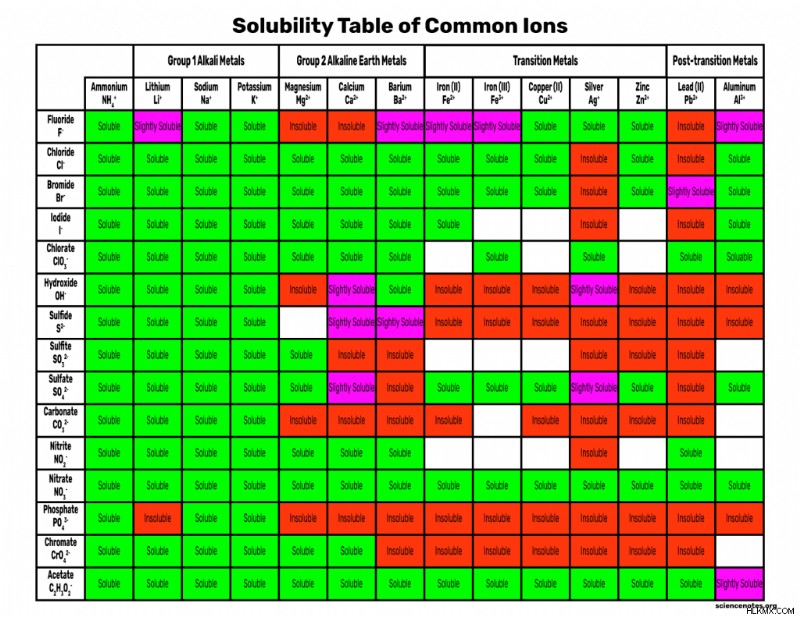
용해도 차트
다음은 다운로드하거나 인쇄 할 수있는 용해도 차트입니다. 마우스 오른쪽 버튼을 클릭하고 이미지를 저장하거나 PDF 파일을 다운로드하십시오.
용해도 규칙을 암기하는 방법
용해도 규칙을 암기하는 가장 쉬운 방법은 니모닉 장치를 사용하는 것입니다. 대부분의 화합물을 덮는 4 개의 니모닉은 NAG, SAG, PMS 및 CASTRO BEAR입니다. Nag와 Sag는 PMS와 Castro Bear가 예외가되면 항상 가용성입니다.
nag
- n itrates (no 3 )
- a Cetates (c 2 H 3 o 2 )
- g Roup 1 (알칼리 금속 :Li, NA, K 등)
SAG
- s ulfates (so 4 )
- a mmonium (nh 4 )
- g Roup 17 (할로겐 :F, CL, BR 등)
pms
예외는 특정 금속 화합물입니다.
- p :PB, 리드
- m :머큐리, hg
- s :은, Ag
카스트로 베어
"Castro Bear"라고 말하는 것은 이러한 금속과 비슷한 이름과 상징을 가진 다른 금속을 쉽게 구별 할 수 있습니다.
- 칼슘 (CA)
- strontium (SR)
- 바륨 (BA)
용해도에 영향을 미치는 요인
몇 가지 요인이 용해도에 영향을 미칩니다 :
- 온도 :용해 반응이 흡열 인 경우 온도에 따라 용해도가 증가하는 경향이 있습니다. 용해가 발열 성이면 온도가 증가함에 따라 용해도가 감소하는 경향이 있습니다. 대부분의 고형물과 액체를 용해시키는 것은 흡열이므로 일반적으로 온도에 따라 용해도가 증가합니다. 유기 화합물의 용해도는 거의 항상 온도에 따라 증가합니다 (예외는 Cyclodextrin). 가스 거동은 더 복잡하고 예측하기 어렵습니다.
- 단계 :용해도는 위상에 따라 다릅니다. 예를 들어, 아라고 나이트의 용해도는 방해석의 용해도와 다르지만, 둘 다 탄산 칼슘의 형태이지만 (Caco 3 . ).
- 다른 종의 존재 :용액의 다른 종은 용해도에 영향을 미칩니다. 요인은 리간드, 공통 이온 및 용액의 이온 강도를 포함합니다.
- 압력 :압력은 고체와 액체의 용해도에 작은 역할을합니다. 대부분의 응용 분야에서 일반적으로 무시되지만, 유정의 황산 칼슘 오염이 발생하는 석유 화학에서는 중요합니다. 황산 칼슘 용해도는 압력 감소에 따라 감소합니다.
- 입자 모양과 크기 :표면적 증가는 용해도, 특히 포화에 접근하는 경향이 있습니다. 따라서 미세 분말은 단일 청크보다 더 가용성입니다. 물질이 결정질인지 비정질인지 여부. 일반적으로 순서가 증가하면 용해도가 줄어 듭니다.
- 극성 :"용해 된 것처럼"극성 용매는 극성 화합물을 용해시키는 반면, 비극성 용매는 비극성 화합물을 용해시키는 반면.
용해도 규칙을 사용하는 방법
용해도 규칙은 화학 물질이 용해 될지 여부를 예측하고, 침전물 형성을 예측하고, 정제하는 샘플을 포함하여 여러 용도로 사용됩니다. 용해도 규칙을 사용하려면 음이온 (이온의 부정적인 부분)을 점검하고 그것이 용해성인지 불용성인지 확인하십시오. 규칙에 대한 예외에주의하십시오.
예를 들어, feco 3 인지 예측하십시오 가용성입니다.
용해도 규칙으로부터, 탄산염 (Co 3 을 함유하는 화합물 ) 불용성 경향이 있습니다. 그래서, feco 3 가능성이 없을 것입니다. 반응의 산물로서, 그것은 침전물을 형성합니다.
예를 들어, 침전물 이이 반응에서 형성되는지 예측합니다.
2AGNO 3 + na 2 s → ag 2 s + 2nano 3
Ag 2 인 경우 침전물이 형성됩니다 s 또는 nano 3 불용성입니다. 용해도 규칙으로부터 황화물은 불용성 인 경향이 있으므로 ag 2 s는 침전물을 형성 할 가능성이 높습니다. 나노 3 대부분의 질산염이 용해되기 때문에 용해성이며 침전물을 형성하지 않습니다. ag 2 이후 s는 침전물을 형성하고,이 반응에서 형성됩니다.
용해도 규칙은 모든 상황에서 행동을 예측하지는 않습니다. 예를 들어, 유기 화합물이나 매우 높은 온도 또는 저온에서 반드시 작동하지는 않습니다. 규칙은 단일 화합물의 순수한 솔루션에 물에 적용되므로 실제 행동은 혼합물에서 예측 된 거동에서 벗어날 수 있습니다. 그들은 "규칙"이라고 불리는 반면, 그들은 실제로 "지침"입니다.
참조
- Hefter, G. T.; Tomkins, R. P. T (Eds.) (2003). 용해도의 실험적 결정 . Wiley-Blackwell. ISBN 978-0-471-49708-0.
- iupac (1997). "용해도". 화학 용어의 개요 (“골드 북”) (2 판). 블랙웰 과학 간행물. doi :10.1351/goldbook.s05740
- Jain, N.; Yalkowsky, S. H. (2001). “수성 용해도 I :유기 비 전해질에 대한 적용”. 제약 과학 저널 . 90 (2) :234–252. doi :10.1002/1520-6017 (200102) 90 :2 <234 ::AID-JPS14> 3.0.co; 2-V
- Petrucci, Ralph H.; et al. (2011). 일반 화학 :원리 및 현대 응용 (10th ed.). 뉴저지 어퍼 새들 리버 :피어슨 교육. ISBN :978-0132064521.
- Ran, Y.; N.자인; S. H. Yalkowsky (2001). "일반적인 용해도 방정식 (GSE)에 의한 유기 화합물의 수성 용해도 예측". 화학 정보 및 모델링 저널 . 41 (5) :1208–1217. doi :10.1021/ci010287z









