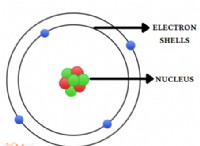
예 :질산 암모늄 (nh₄no₃)
* 이온 결합 : 암모늄 이온 (NH₄⁺)은 질소와 4 개의 수소 원자 사이의 공유 결합에 의해 형성된다. 암모늄 이온은 양전하가되어 양이온이됩니다.
* 공유 본드 : 질산염 이온 (NOI)은 질소와 3 개의 산소 원자 사이의 공유 결합에 의해 형성된다. 질산염 이온은 음전하가있어 음이온이됩니다.
* 이온 결합 (이온 사이) : 암모늄 양이온 (NH₄⁺) 및 질산염 음이온 (NOI)은 이온 결합을 형성하여 화합물을 함께 유지합니다.
전자 도트 다이어그램 :
간단한 전자-도트 다이어그램을 사용하여 이온 성 및 공유 결합이있는 화합물을 정확하게 나타내는 것은 어렵다. 전자 도트 다이어그램은 개별 이온 내에 결합을 보여주는 데 가장 적합합니다.
여기에 시각화하는 방법은 다음과 같습니다.
1. 개별 이온 : 암모늄 (NH₄⁺) 및 질산염 (NOA) 이온에 대한 전자 도트 다이어그램을 별도로 그립니다.
* 암모늄 이온 (NH₄⁺) :
* 질소 (N)는 5 개의 원자가 전자를 가지며 각 수소 (H)는 1 을가집니다.
* 질소는 4 개의 수소 원자와 전자를 공유하여 4 개의 공유 결합을 형성하고 이온은 +1 전하를 갖는다.
* 질산 이온 (No₃⁻) :
* 질소 (N)는 5 개의 원자가 전자를 가지며 각 산소 (O)는 6이 있습니다.
* 질소는 공유 결합을 형성하기 위해 3 개의 산소 원자와 전자를 공유하고 이온은 -1 전하를 갖는다.
2. 이온 결합 : 양성 암모늄 이온 (NH₄⁺)과 음성 질산염 이온 (NOI)은 정전기력으로 인해 서로를 끌어 이온 결합을 형성합니다.
키 포인트 : 전자-도트 다이어그램은 각 개별 이온 내에서만 결합을 나타낼 수 있습니다. 이온 성 및 공유 결합을 모두 포함하는 화합물의 전체 구조를 완전히 묘사 할 수는 없습니다.
기억하십시오 : 질산 암모늄 (nh₄no₃) 의이 예는 이온 성 및 공유 결합 둘 다를 갖는 화합물의 한 인스턴스 일뿐입니다. 수산화 나트륨 (NAOH) 및 탄산 칼슘 (CACO₃)과 같은 다른 많은 예가 있습니다.