핵심 개념 :
원자는 무엇입니까? 원자 구조 에 대한이 튜토리얼에서 , 당신은 각 영역에서 발견되는 아 원자 입자와 함께 원자의 다른 부분에 대해 배웁니다. 또한 아 원자 입자를 통해 찾을 수있는 특성에 대해서도 배웁니다. 이러한 특성에는 원자 번호 가 포함됩니다 , 원자 질량 및 순 충전 . 또한 원자 정의 - 전자, 양성자 및 중성자가 무엇인지를 배웁니다.
다른 기사에서 다루었습니다 :
- 양성자, 중성자 및 전자 정량화
- 이온/공유 결합
- 전자 구성을 작성하는 방법
- 주기적 트렌드
- 주기적인 테이블을 읽는 방법
- 전자가 발견 된 방법
- 원자의 Bohr 모델
- 달튼의 원자 모델
- 원자 반응
원자는 무엇입니까?
그래서 원자의 정의는 무엇입니까 ? 원자는 요소의 특성을 결정하는 데 사용되는 물질의 빌딩 블록입니다. 요소의 정의를 배우십시오.
원자는 결합을 통해 서로 상호 작용하여 분자라고도하는보다 복잡한 물질을 형성 할 수 있습니다. 이러한 상호 작용은 고체, 액체 또는 가스로 발견 될 수 있으므로 원자가있는 물질의 상태를 결정합니다.
원자의 일부는 무엇입니까?
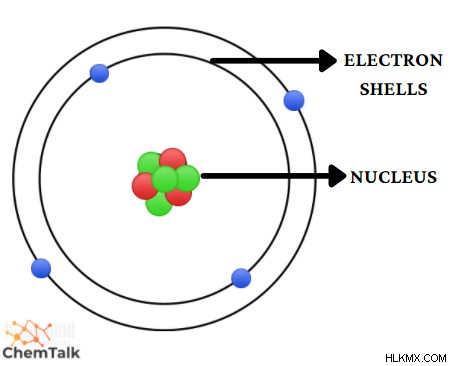
원자는 양성자 로 구성된 아 원자 입자로 알려진 3 개의 기본 성분으로 구성됩니다. (양수 가하), 중성자 (전하 없음) 및 전자 (부정적인 부과). 이것들은 원자의 일부입니다.
이 빌딩 블록의 원자 구조는 매우 흥미 롭습니다. 양성자와 중성자는 원자의 중심에 위치하고 전자는 중심에서 상당히 멀리 떨어져 있습니다. 이 원자 입자를 더 자세히 살펴 보겠습니다.
중요한 개념 :
- 원자는 양성자, 중성자 및 전자라고 불리는 매우 작은 입자로 구성됩니다 - 원자의 일부.
- 양성자와 중성자는 원자의 중심에 있으며 핵을 구성합니다.
- 양성자는 양전하가 있습니다.
- 중성자는 중립 전하 (전하 없음)
- 전자는 음전하가 있고 핵에서 멀리 떨어져 있습니다.
- 양성자와 전자의 전하는 크기가 정확히 동일하지만 부호는 반대입니다.
- 양성자와 전자는 반대의 충전이 있기 때문에 서로를 매료시킵니다.
양성자 란 무엇입니까?
양성자 정의 : 양성자는 모든 원자의 핵에서 발견되는 양 아 원자 입자입니다. 양성자의 전하는 +1입니다. 원소의 원자 수는 핵의 양성자 수와 같습니다. 양성자는 두 개의 쿼크와 1 개의 쿼크로 구성됩니다. 질량은 1.007277 AMU (원자 질량 단위)입니다.
중성자 란 무엇입니까?
중성자 정의 : 그래서 중성자는 무엇입니까? 중성자는 수소를 제외한 모든 원자의 핵에서 발견되는 중성 하전 하위 원자 입자입니다. 중성자는 양성자보다 약간 더 많은 질량을 가지고 있습니다.
중성자는 하나의 쿼크와 2 개의 다운 쿼크로 구성된 Hadron의 유형입니다. 질량은 1.008665 AMU (원자 질량 단위)입니다. 베타 붕괴에서 중성자는 양성자, 전자 및 항 핵형으로 변형 될 수 있습니다. 양성자와 중성자는 둘 다 핵 이라고합니다 .
중성자는 원소의 동위 원소를 결정하기 때문에 중요합니다. 예를 들어, 6 개의 중성자가있는 탄소는 탄소 -12이지만 중성자 2 개를 추가하면 탄소 14를 얻습니다.
전자 란 무엇입니까?
전자 정의 : 전자는 원자의 핵을 공전하는 아 원자 입자이다. 그것들은 부정적이며 양성자 또는 중성자보다 훨씬 작습니다. 실제로, 그들은 1,800 배 더 작습니다. 그들은 또한 전기를 운반합니다. 전자의 전하는 -1입니다. 전자는 1.6 x 10-19 쿨롱을 전달합니다. 그들은 알려진 성분이나 하위 구조가 없습니다. 그들은 질량이 .000549 amu입니다.
핵은 무엇입니까
원자 구조에 대해 더 이야기 해 봅시다. 원자의 중심은 핵 라고합니다. 양성자와 중성자로 구성됩니다. 원자 의이 부분은 원자 번호 와 같은 광범위한 특성을 결정할 수 있습니다. 및 원자 질량 .
원자 번호 핵에 존재하는 양성자의 수를 통해 요소의 요소가 발견된다. 예 :탄소에는 핵에 6 개의 양성자가있어 주기율표에 여섯 번째 요소가 있습니다.
원자 질량을 찾는 방법
요소의 원자 질량을 찾는 가장 쉬운 방법은 주기율표를 보는 것입니다. 원자 질량 중성자와 양성자의 수를 추가하여 계산할 수도 있습니다. 이것은 실제로 작은 질량을 가진 전자 때문이므로 원자 질량에 크게 기여하지 않습니다. 예 :8 개의 양성자 및 8 개의 중성자를 함유하는 산소 원자는 원자 질량이 16 amu를 갖는다 (양성자 및 중성자의 질량은 약 1 amu). 각 동위 원소의 풍부함을 알고 있다면 원자량으로 알려진 평균 원자 질량을 계산할 수도 있습니다.
핵이 발견 된 방법에 대해 배울 수 있습니다.
전자 쉘이란 무엇입니까
전자 쉘 핵을 둘러싼 원자의 가장 바깥 쪽 영역에 위치하고 있습니다. 이 영역에는 전자 만 포함되어 있으며 순 전하 를 결정할 수 있습니다. 원자의.
순 전하 원자의 총 전자 및 양성자 수의 차이에 의해 결정된다. 원자에 전자보다 더 많은 양성자가 포함 된 경우 순 전하는 양전하고 그 반대도 마찬가지입니다. 예 :5 개의 양성자와 3 개의 전자를 함유하는 원자는 +2 순 전하를 갖습니다.
 원자의 일부 - 어휘 정의 :
원자의 일부 - 어휘 정의 : 양성자 :핵에 존재하는 양 아 원자 입자.
중성자 :핵에 존재하는 중성 하전 하위 원자 입자.
전자 :핵을 둘러싼 전자 껍질에서 발견 된 음으로 하전 된 아 원자 입자.
핵 :양성자와 중성자를 모두 포함하는 원자의 중앙에 위치한 영역.
전자 쉘 :전자를 포함하는 원자의 가장 바깥 쪽 영역에 위치한 영역.
원자 구조 : 양성자, 중성자 및 전자가 원자에 배열되는 방법