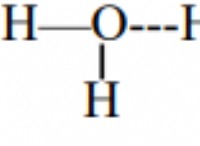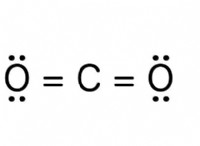1. poh를 계산하십시오 :
* pH와 POH의 관계는 :pH + poh =14입니다.
* 따라서 POH =14- pH =14-1095 =3.05
2. poh :를 사용하여 [OH-]를 계산하십시오
* POH와 [OH-]의 관계는 :poh =-log [OH-]입니다.
* 방정식 재 배열 :[OH-] =10^(-poh)
* poh 값을 대체하십시오 :[OH-] =10^(-3.05) = 8.91 x 10^-4 m
따라서, 용액의 수산화 이온 농도 ([OH-])는 8.91 x 10^-4 m입니다.