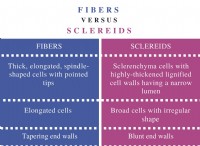
1. 글리신의 루이스 구조
먼저 글리신의 루이스 구조 (NH2CH2COOH)를 그립니다.
```
h o
| ||
H -N -C -C -O -H
| |
H 오
```
2. 중앙 원자를 식별하십시오
문제의 중심 원자는 질소 (N) 원자입니다.
3. 중앙 원자 주위의 전자 그룹을 계산하십시오
* 본딩 전자 그룹 : 질소 원자는 3 개의 단일 결합 (1 ~ 탄소, 2 개에서 수소)을 갖는다. 이것은 3 개의 전자 그룹에 기여합니다.
* 고독한 쌍 : 질소 원자에는 하나의 고독한 전자 쌍이 있습니다. 이것은 1 전자 그룹에 기여합니다.
4. VSEPR 공식을 결정하십시오
질소 원자 주변의 전자 그룹의 총 수는 3 + 1 =4입니다.
4 개의 전자 그룹에 대한 VSEPR 공식은 ax4 이다 , 이는 사면체에 해당한다 전자 형상.
5. 분자 형상
질소 원자는 하나의 고독한 쌍을 가지기 때문에 분자 기하학은 Trigonal Pyramidal 입니다. .
따라서, 글리신의 질소 원자에 대한 VSEPR 공식은 AX4이며, 이는 사면체 전자 형상 및 삼각 피라미드 분자 형상에 해당한다. .