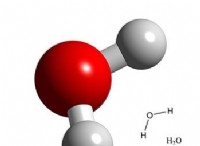
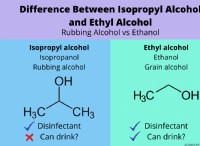
이유는 다음과 같습니다.
* 중앙 원자 : 유황은 중심 원자입니다.
* 전자 쌍 : 황은 6 개의 원자가 전자를 가지며, 각 산소 원자는 6 개의 전자를 기여합니다. 이것은 총 18 개의 원자가 전자를 제공합니다.
* 결합 및 고독한 쌍 : 황은 4 개의 전자를 사용하여 각 산소 원자와 이중 결합을 형성합니다. 이것은 14 개의 전자 또는 7 개의 전자 쌍을 남깁니다. 이 중 2 개는 황 원자의 고독한 쌍입니다.
* VSEPR 이론 : VSEPR (Valence Shell Electron Pair 반발) 이론에 따르면, 중앙 원자 주변의 전자 쌍은 가능한 한 멀리 떨어져서 반발을 최소화하려고 시도합니다. 황 주변의 두 개의 이중 결합과 두 개의 고독한 쌍은 사면체 전자 형상을 만듭니다. 그러나, 고독한 쌍은 결합 쌍보다 더 많은 공간을 차지하기 때문에 분자의 모양이 왜곡되어 구부러진 또는 V 형 분자 형상이 생성됩니다.
분자의 다이어그램을 원하시면 알려주세요!