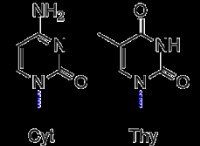
h₄so₂ (aq) + ba (no₃) ₂ (aq) → baso₄ (s) + 2 hno₃ (aq)
설명 :
* 반응물 : 황산 (HASSOA)은 강산이며, 질산염 (BA (NOIT) ₂)은 가용성 이온 성 화합물입니다.
* 제품 :
* 바륨 황산염 (Baso₄) : 이것은 용액에서 벗어나는 흰색, 불용성 고체입니다. 이 반응의 특징적인 제품입니다.
* 질산 (hno₃) : 이것은 용액에 용해 된 강한 산입니다.
* 메커니즘 : 반응은 반응물 사이의 이온 교환을 포함한다. 질산 바륨으로부터의 바륨 이온 (Ba²⁺)은 황산으로부터의 설페이트 이온 (SOJET)과 결합하여 불용성 바륨 황산염을 형성한다. 황산으로부터의 수소 이온 (HAT)은 질산염으로부터 질산염 이온 (NOI)과 결합하여 질산을 형성한다.
관찰 :
* 황산과 질산 바륨의 용액을 혼합하면 즉시 흰색의 흐린 침전물 형성을 관찰 할 것입니다 (바륨 황산염).
* 용액은 질산의 형성으로 인해 약간 산성이됩니다.
사용 :
이 반응은 다양한 응용 분야에서 사용됩니다.
* 분석 화학 : 바륨 설페이트 침전물의 형성은 바륨 이온의 질적 및 정량 분석에 사용된다.
* 산업 응용 : 황산 바륨은 페인트 안료, 종이 및 고무의 생산에 사용됩니다.
안전 고려 사항 :
* 황산과 질산은 부식성이며 심한 화상을 유발할 수 있습니다. 이 화학 물질을주의해서 처리하고 적절한 보호 장비를 착용하십시오.
* 바륨 염은 독성입니다. 침전물과의 접촉을 피하고 올바르게 폐기하십시오.