주요 차이 - 이산화탄소 대 탄소 일산화탄소
가스는 모든 문제가 존재할 수있는 세 가지 주요 상태 중 하나입니다. 다른 두 가지 유형은 고체와 액체입니다. 가스는 고체와 액체가 가지고 있지 않은 고유 한 특성을 가지고 있습니다. 가스 분자는 매우 작으며 가스 분자 사이의 상호 작용은 거의 없습니다. 다양한 원소와 분자는 실온에서 가스로 존재합니다. 이산화탄소 및 일산화탄소는 이러한 두 가스입니다. 주요 차이 이산화탄소와 일산화탄소 사이에는 이산화탄소가 2 개의 산소 원자와 탄소 원자와 함께 구성되는 반면, 일산화탄소는 탄소 원자와 함께 하나의 산소 원자로 구성된다는 것이 있습니다. .
주요 영역을 다루었습니다
1. 이산화탄소
- 정의, 구조, 속성, 응용 프로그램
2. 일산화탄소
- 정의, 구조, 속성, 응용 프로그램
3. 이산화탄소와 일산화탄소의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :탄소, 탄산 산, 이산화탄소, 일산화탄소, 쌍극자, 이중 결합, 몰 질량, 분자 공식, 산소, 광합성, 삼중 결합 
이산화탄소
이산화탄소는 분자 공식 Co 2 를 갖는 실온에서의 가스입니다. . 이 가스는 살아있는 유기체의 호흡 중에 방출되므로 매우 흔합니다. 또한 자동 영역의 광합성 과정에서 주요 구성 요소입니다.
이산화탄소 분자의 분자 질량은 약 44 g/mol입니다. 무색과 무취 가스입니다. 이산화탄소의 분자 모양은 선형입니다. 2 개의 산소 원자는 공유 이중 결합으로 양면에 의해 탄소 원자에 부착된다. 하나의 c =O 결합의 길이는 약 116.3 pm입니다. 분자는 대칭입니다. 따라서 쌍극자가 아닙니다. (쌍극자는 해당 분자에서 보유한 결합의 유형으로 인해 원자에 부분 전하가있는 분자입니다).
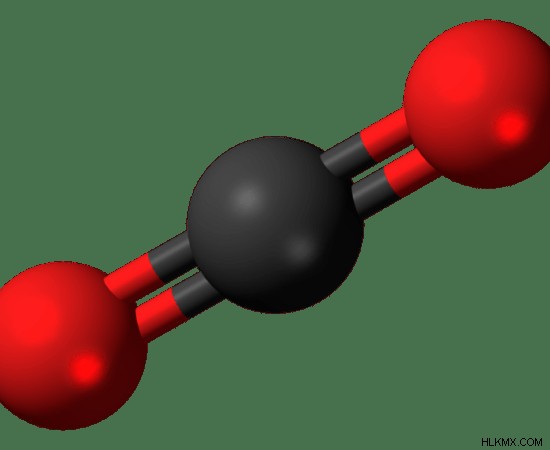
그림 01 :이산화탄소 분자의 3D 스틱 및 볼 구조. 탄소 원자는 검은 색으로 표시되는 반면 두 산소 원자는 붉은 색입니다.
이산화탄소는 물에 잘 녹아 탄산 산 (h 2 Co 3 ). 그러나 탄산은 수용액에서 약산이다; 따라서, 그것은 부분적으로 이온에 분리된다. 따라서 물의 이산화탄소와 카본 산 사이에는 평형이 있습니다.
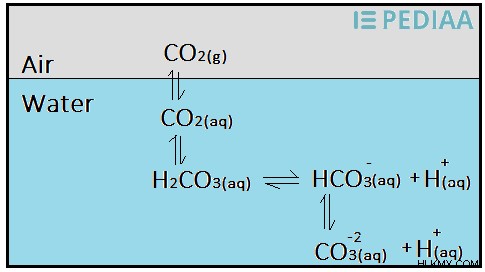
그림 02 :대기 이산화탄소를 물에 용해시킬 수 있습니다.
대기에서 이산화탄소의 함량은 약 0.03%이며 빠르게 증가하고 있습니다. 이 증가는 주로 화석 연료 연소 및 삼림 벌채로 인한 것입니다. 화석 연료 연소의 주요 제품 중 하나는 이산화탄소입니다. 대기 이산화탄소의 대부분은 숲에 흡수됩니다. 다시 말해, 이산화탄소는 광합성 과정을 위해 나무에 의해 사용됩니다. 그러나 삼림 벌채로 인해 식물상이 취한 이산화탄소의 양은 감소합니다. 결과적으로 대기에서 이산화탄소의 비율이 올라갑니다.
그러나, 이산화탄소는 온실 가스이기 때문에 대기 중 이산화탄소의 증가 된 양은 바람직하지 않습니다. 온실 가스는 적외선을 흡수하고 방출 할 수 있습니다. 이로 인해 지구 온난화가 급격히 증가합니다.
일산화탄소
일산화탄소는 실온에서 가스이며 분자식 CO . 그것은 하나의 탄소 원자와 하나의 산소 원자로만 구성됩니다. 따라서 구조는 본질적으로 선형입니다. 산소 원자는 공유 원자에 결합된다. 그러나 이산화탄소와 달리, 일산화탄소는 탄소와 산소 사이의 삼중 결합을 갖는다. 트리플 본드는 이중 결합과 조정 결합으로 구성됩니다. 이중 결합의 형성 후, 산소 원자에 2 개의 고독한 전자 쌍이있다. 이들 고독한 쌍 중 하나는 안정적인 분자를 형성하기 위해 탄소 원자에 기증된다. 그렇지 않으면, 탄소 원자는 옥트 규칙을 준수하지 않으며 두 고독 쌍은 서로를 격퇴하여 불안정한 분자를 초래합니다.
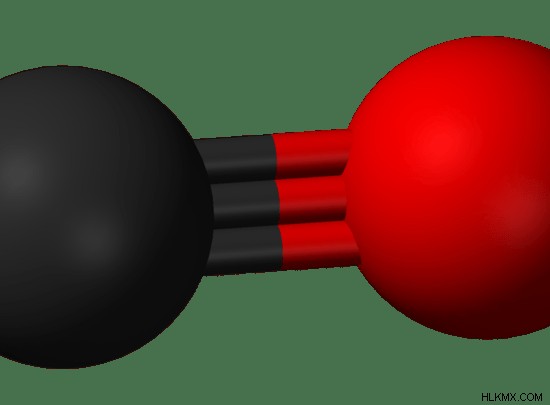
그림 03 :이산화탄소의 스틱 및 볼 구조. 탄소 원자는 검은 색이며 산소 원자는 붉은 색입니다.
탄소와 산소 사이의 결합 길이는 약 112.8 pm입니다. 이산화탄소는 탄소와 산소 사이의 이중 결합을 갖는 반면 일산화탄소는 탄소와 산소 사이의 삼중 결합을 가지기 때문에 이산화탄소의 탄소보다 적습니다. 트리플 결합은 두 원자를 이중 결합보다 단단히 부착하므로 결합 길이가 감소합니다.
산소 원자는 탄소보다 전기 음성이기 때문에 일산화탄소 분자에는 약간의 쌍극자 모멘트가 있습니다. 그러나 전자를 탄소에 기증하는 배위 결합이 있기 때문에 강한 쌍극자가 아닙니다 (쌍극자는 탄소 원자에 부분 양전하를 초래하고 산소에 의해 기증 된 전자는이 전하의 양을 중화시킬 수 있습니다).
.대기에는 일산화탄소가 거의 없습니다. 일산화탄소는 독성 가스로 간주됩니다. 이것은 혈액에서 헤모글로빈과 결합 할 수 있기 때문에 (산소 분자가 결합하는 경우) 산소의 신체 세포로의 수송을 차단할 수 있기 때문입니다. 따라서 신체 세포는 그 세포의 사망을 유발할 수있는 충분한 산소를 얻지 못합니다.
일산화탄소는 화석 연료의 불완전한 연소의 부산물입니다. 건조한 공기에 많은 양의 일산화탄소가 존재하면 오염 된 공기로 간주됩니다.
이산화탄소가 가열 숯 (탄소)을 통과 할 때 일산화탄소가 생성됩니다. 일산화탄소는 이산화탄소로 산화시킴으로써 환원제로서 작용한다. 일산화탄소에서 탄소의 산화 상태는 +2이고 이산화탄소에서 +4 상태로 산화된다. 그 외에도, 일산화탄소는 Cuo (구리 산화물)로부터 구리 금속 (Cu)을 분리하는데 사용될 수있다. 반응은 다음과 같습니다.
cuo (s) +co (g) → cu (s) +Co 2 (g)
일산화탄소의 주요 반응은 전이 금속과의 반응입니다. 이 기능은 화합물에서 순수한 전이 금속 요소를 얻는 데 사용됩니다. 예 :니켈의 정제
이산화탄소와 일산화탄소의 차이
정의
이산화탄소 : 이산화탄소는 상온에서의 가스이며 분자식 Co 2 를 갖는 가스입니다. .
일산화탄소 : 일산화탄소
구성
이산화탄소 : 이산화탄소는 2 개의 산소 원자에 결합 된 탄소 원자로 구성됩니다.
일산화탄소 : 일산화탄소는 하나의 산소 원자에 결합 된 탄소 원자로 구성됩니다.
몰 질량
이산화탄소 : 이산화탄소의 몰 질량은 약 44 g/mol입니다.
일산화탄소 : 일산화탄소의 몰 질량은 약 28 g/mol입니다.
탄소-산소 결합 길이
이산화탄소 : 탄소와 산소 사이의 결합 길이는 이산화탄소에서 약 116.3 pm입니다.
일산화탄소 : 탄소와 산소 사이의 결합 길이는 일산화탄소 약 112.8 pm입니다.
본딩
이산화탄소 : 이산화탄소에서 탄소와 산소 사이에는 공유 이중 결합이 있습니다.
일산화탄소 : 일산화탄소에서 탄소와 산소 사이의 공유 이중 결합과 배위 결합 (모두 트리플 결합)이 있습니다.
형성
이산화탄소 : 이산화탄소는 화석 연료의 완전한 연소에 의해 생산됩니다.
일산화탄소 : 일산화탄소는 화석 연료의 불완전한 연소에 의해 생성됩니다.
화학 반응
이산화탄소 : 이산화탄소는 산화 반응을 겪을 수 없습니다.
일산화탄소 : 일산화탄소는 산화 반응을 겪을 수있다.
결론
이산화탄소는 환경에 유용한 가스로 간주되지만 지구 온난화를 일으키기 때문에 너무 많지 않습니다. 일산화탄소는 독성 가스로 간주되고 일산화탄소의 흡입은 혈액에서의 산소 수송 억제로 인해 세포의 사망을 유발한다. 그러나, 두 가스는 대기 중에 미량 금액으로 존재하며, 이들 가스의 비율은 인간 활동으로 인해 빠르게 증가하고있다. 이산화탄소와 일산화탄소의 주요 차이점은 구조와 조성입니다.