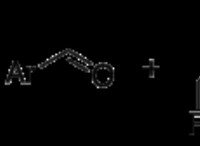
예측 된 루이스 구조와 그 문제 :
* 예측 : 표준 루이스 구조는 두 산소 원자 사이의 이중 결합을 예측하고, 각 산소 원자는 2 개의 고독 쌍을 갖는다. 이 구조는 두 산소 모두에 대한 옥트 규칙을 충족시킵니다.
* 문제 : 이 구조는 산소 분자가 디아마그네틱해야한다는 것을 의미합니다 (짝을 이루지 않은 전자). 그러나 실험은 산소가 상자성 임을 보여줍니다 - 짝을 이루지 않은 전자가 있으며 자기장에 끌립니다.
표준 루이스 구조가 실패하는 이유 :
표준 루이스 구조는 다음을 설명하지 못합니다.
* 채권 명령 : 산소의 결합 길이는 단일 결합보다 짧지 만 이중 결합보다 길다. 이것은 1과 2 사이의 채권 순서를 시사합니다.
* 분자 궤도 이론 : 분자 궤도 이론은 산소의 결합에 대한보다 정확한 그림을 제공합니다. 산소 원자의 2P 궤도가 조합하여 시그마 및 PI 결합 궤도 및 항 바이 본딩 궤도를 형성 함을 보여준다. 두 개의 짝을 이루지 않은 전자는 항비 PI 궤도를 차지하여 상용기를 설명합니다.
올바른 설명 :
산소 분자에 대한 올바른 설명은 분자 궤도 이론을 포함합니다 , 그것은 매개 변수와 채권 순서를 설명합니다. 분자 궤도 다이어그램은 산소 분자가 항의 궤도에 2 개의 짝을 이루지 않은 전자를 가지고있어 상자성 거동을 초래한다는 것을 보여준다. 결합 및 안티 본딩 전자의 수에서 계산 된 결합 순서는 약 2이며, 이는 관찰 된 결합 길이와 일치한다.
키 테이크 아웃 :
루이스 구조는 기본 결합을 이해하는 데 유용한 도구이지만, 특히 비정상적인 행동을 나타내는 산소와 같은 분자에 대해 분자 결합의 복잡성을 완전히 포착 할 수는 없습니다. 분자 궤도 이론은 그러한 경우 전자 구조와 결합을보다 정확하게 표현합니다.