이유는 다음과 같습니다.
* 베이스의 정의 : 염기는 양성자 (H+ 이온)를 받아들이거나 전자 쌍을 기증하는 물질입니다.
* 양성자 전달 : 산과 염기 사이의 반응은 양성자의 전달을 포함한다. 염기는 산으로부터 양성자를 받아들이고 그의 공액 산을 형성하는 반면, 산은 양성자를 잃어 접합체의 염기를 형성한다.
* 양성자 소스 : 두 개의 염기가있는 경우 반응이 발생할 수있는 양성자 공급원이 없습니다.
예 :
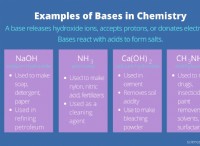
수산화 나트륨 (NAOH)과 수산화 칼륨 (KOH)과 같은 두 가지 강력한 염기가 있다고 상상해보십시오. 둘 다 용액에서 수산화 이온 (OH-)을 쉽게 기증합니다. 그러나 전달할 양성자가 없기 때문에 서로 반응하지 않습니다.
예외 :
* 금속 수산화물 반응 : 일부 금속 수산화물은 서로 반응하여 혼합 금속 산화물을 형성 할 수 있습니다. 예를 들어, 수산화 바륨 (BA (OH) 2)는 수산화 나트륨 (NAOH)과 반응하여 수산화 나트륨 (BanaOH2)을 형성 할 수 있습니다.
* 루이스 산-염기 반응 : 특정 상황에서 한 기초는 다른베이스를 향한 루이스 산 (전자 쌍 수용체) 역할을 할 수 있습니다. 이것은 덜 일반적이지만 특정 반응에서 발생할 수 있습니다.
일반적으로 용액에 두 개의 염기가있을 때, 그들은 서로 반응하기보다는 접합체 산과 평형에 존재할 것입니다. .