화학에서 베이스 산과 반응하여 염을 형성하고 수산화물 이온을 방출하거나, 양성자를 받아들이거나, 수용액에 전자를 기증하는 물질입니다. 기지의 속성에 대해 배우고 기지의 예와 그 용도를 참조하십시오.
기본 정의
모든 염기는 산과 반응하여 염을 형성하지만, 정확히 기지가 무엇인지에 대한 다른 정의가 있습니다. 각 기본 정의에는 해당 산성 정의가 있습니다.
- Arrhenius :Arrhenius Base는 수성 용액으로 수산화물 이온 (OH)을 방출합니다. Arrhenius acid는 수용액에서 수소 이온 (H)을 방출합니다. 베이스는 조제에 hydroxide (OH)가 Arrhenius베이스가 될 필요가 없습니다. 예를 들어, 암모니아 (NH <서브> 3 )는 암모늄 이온을 형성하는 물에서 반응한다 (NH <서브> 4 ) 및 수산화 이온 (OH).
- Brønsted - lowry :Brønsted-Lowry Base는 양성자 수용체입니다. Arrhenius 산은 양성자 수용체입니다.
- 루이스 : 루이스베이스는 전자 쌍 기증자입니다. Arrhenius 산은 전자 쌍 수용체입니다.
산과 염기는 화학 반응에서 반대 종처럼 보일 수 있지만 일부 물질은 산 또는 염기 역할을 할 수 있습니다. 그러한 종은 양서류 이라고합니다 . 물은 약산 (수소 이온 또는 양성자를 기증) 또는 약산 (OH를 기증하거나 H <서브> 3 를 형성하기 위해 양성자를 수용하는 역할을 할 수 있기 때문에 고전적인 예입니다. o + ).
강하고 약한베이스
강한베이스 수용액에서 이온에 완전히 분리되는 화합물이다. 약한베이스 불완전하게 이온에 분리되어 생성 된 수용액에는 약한 염기, 접합체 산 및 물이 포함되어 있습니다.
강한베이스 :Boh + H 2 O → B (aq) + OH (aq)
약한베이스 :boh + h 2 o) b (aq) + 오 (aq)
또는
약한베이스 :B + H 2 o q bh (aq) + oh (aq)
강력한베이스는 알칼리 또는 알칼리성 지구 금속 및 수산화 이온으로 만든 고전적인 Arrhenius베이스입니다.
| 일반적인 강한베이스 | 공식 | |
|---|---|---|
| 바륨 하이드 록 사이드 | ba (OH) | |
| 칼슘 히드 록 사이드 | ca (OH) | |
| Cesium hydroxide | csoh | |
| 리튬 하이드 록 사이드 | lioh | |
| 수산화 칼륨 | koh | |
| Rubidium Hydroxide | rboh | |
| 나트륨 하이드 록 사이드 | naoh | |
| Strontium hydroxide | sr (OH) |
| 일반적인 약한베이스 | 공식 | |
|---|---|---|
| 암모니아 | nh 3 | |
| 트리메틸 암모니아 | n (ch 3 ) | |
| 피리딘 | c 5 h 5 n | |
| 암모늄 하이드 록 사이드 | nh 4 오 | |
| 물 | h 2 o | |
| 메틸 아민 | ch 3 nh 2 | |
| 나트륨 중탄산염 | nahco 3 |
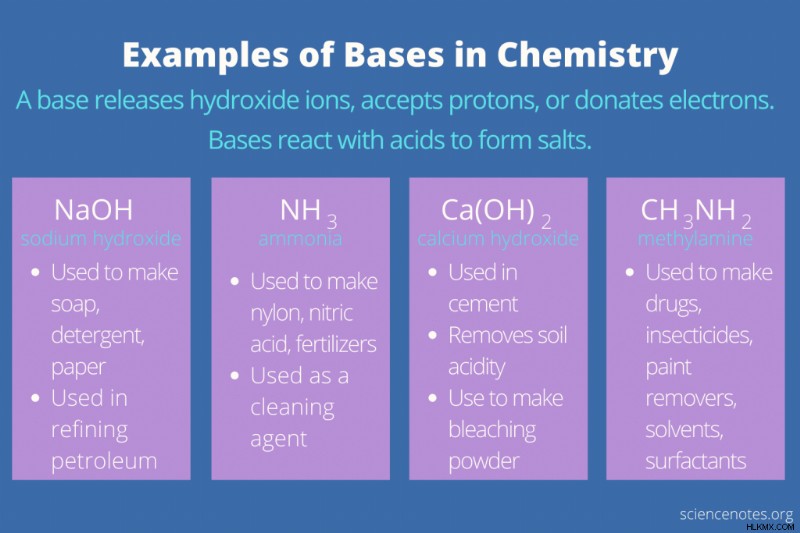
| 이름 | 공식 | 사용 |
| 나트륨 하이드 록 사이드 | naoh | 비누 만들기, 세제, 종이; 배수 클리너; 정제 석유 |
| 수산화 칼륨 | koh | 비누 만들기; 배터리 전해질 |
| 칼슘 히드 록 사이드 | ca (OH) | 석고 만들기; 가죽 생산 |
| 마그네슘 히드 록 사이드 | mg (OH) | 완하제; antacid |
| 암모니아 | nh 3 | 나일론, 질산, 비료 만들기; 청소제 |
| 알루미늄 하이드 록 사이드 | al (OH) | 제산제; 탈취제 |
| 메틸 아민 | ch 3 nh 2 | 약물, 살충제, 페인트 제거제, 계면 활성제 | 제작
| 피리딘 | c 5 h 5 n | 알코올 변성; 용제; 염료, 약물, 고무 제품, 비타민 만들기 |
| 아연 히드 록 사이드 | zn (OH) | 수술 드레싱의 흡수; 살충제와 안료 만들기 |
| 리튬 하이드 록 사이드 | lioh | 윤활 그리스 및 리브레더 만들기 |