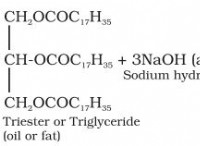* 중화 반응 : 수산화 나트륨은 강한 염기이며 염산은 강한 산입니다. 그들이 반응 할 때, 그들은 1 :1 어금니 비율로 서로를 중화시킵니다.
* 어금니 문제 : 결과 용액의 pH는 전적으로 각 반응물의 양에 따라 다릅니다.
* 과잉 Naoh : HCL보다 NAOH가 더 많으면 용액이 기본적입니다 (pH> 7).
* 초과 hcl : NAOH보다 HCL이 더 많으면 용액이 산성이됩니다 (pH <7).
* 동일한 양 : 양이 같으면 용액은 중립적입니다 (pH =7).
pH를 계산하려면 :
1. NaOH 및 HCl의 농도를 결정합니다.
2. 반응의 화학량 론을 사용하여 제한 반응물을 찾습니다. 이것은 완전히 소비되는 반응물입니다.
3. 나머지 반응물의 농도를 계산합니다.
4. 나머지 반응물 (산 또는 염기)에 적합한 pH 공식을 사용하십시오.
예 :
0.1 M NAOH 및 0.2 M HCL을 동일한 부피로한다고 가정 해 봅시다.
1. 반응물 제한 : HCL은 농도가 높기 때문에 제한 반응물입니다.
2. 남아있는 naoh : 반응 후, NaOH의 농도는 감소 할 것이다. 초기 농도와 화학량 론에 따라 새로운 농도를 계산해야합니다.
3. pH 계산 : 나머지가 남아 있으므로 POH 공식 (POH =-LOG [OH-])을 사용한 다음 PH (PH + POH =14)로 변환합니다.