하이브리드 화
왜 다른 분자 나 화합물이 다른 모양을 보여주는 지 궁금한 적이 있습니까? 중앙 원자와 다른 원자 사이의 결합이 특정 방식으로 형성되는 이유는 무엇입니까? 분자의 형상과 공간 배열을 변화시키는 개념은 무엇입니까?
다른 분자의 모양, 에너지 등을 배열하는 데 중요합니다. 이제 하이브리드 화가 무엇이며 어떻게 결합을 배열합니까? 이 기사는이 질문에 답할 것입니다.
하이브리드 화가 뭐야?
결합 특성을 설명하는 데 적합한 고급 하이브리드 궤도를 형성하는 것은 원자 궤도를 혼합하는 가설입니다. 그것은 원자의 원자가 궤도의 완전히 새로운 모양과 방향으로 이어집니다.
본드와 고독한 쌍이있을 때 전자가 어디에 있는지 예측하려는 시도입니다. 원자 궤도가 어울려 새로운 원자 궤도를 형성 할 때 발생합니다. 고급 궤도는 이전 궤도와 동일한 전자 용량을 갖습니다. 새롭고 하이브리드 화 된 궤도의 에너지와 특성은 원래의 가축 구조화 된 궤도의 '평균'입니다.
하이브리드 화의 개념을 도입해야 할 필요성은 메탄과 같은 분자의 모든 C-H 결합이 구별 할 수 없다는 확실성에 대한 최고의 설명이었다.
혼성화 개념
Linus Pauling은 혼성화의 개념을 도입했습니다. 이 개념은 ch 4 와 같은 두 개 이상의 원자를 가진 분자의 특징적인 치수 모양을 설명합니다. , h 2 o, nh 3 그는 원자 궤도가 통합되어 하이브리드 궤도로 인식되는 새로운 동일한 궤도 세트를 형성한다고 제안했다. 순수한 궤도와는 달리, 혼합 된 궤도는 결합을 형성하는데 사용된다. 이러한 에피소드는 혼성화로 인식됩니다. 이 과정은 약간 다른 에너지의 궤도를 혼합하여 재분배 할 수 있으며, 동등한 에너지와 모양의 새로운 궤도 세트가 형성 될 수 있습니다.
.유형의 하이브리드 화
S, P 및 D 궤도와 관련된 다양한 유형의 혼성화가 있습니다. 다른 유형은 다음과 같습니다.
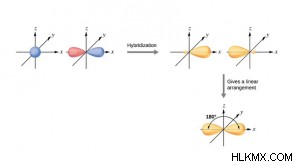
- SP 혼성화 :
- 1 p 및 1 개의 궤도 블렌드, 2 개의 SP 복합재 (또는 하이브리드) 궤도를 형성합니다.
- 그것들은 동등하고 대칭적인 하이브리드 궤도입니다.
- 각 SP 하이브리드 궤도는 동일한 특성, 즉 50% s- character 및 50% p-character를 가지고 있습니다.
- 형성된 분자는 형상에서 선형이므로 180 °의 결합 각도가 있습니다.
- s-orbital은 구형이며 p- 궤도는 배 모양이지만 s와 p 궤도의 혼합으로 얻은 SP 하이브리드 궤도는 타원형입니다.
- 이 유형의 하이브리드 화는 대각선 혼성화라고도합니다. 즉, 공간 배열은 반대 방향으로 직선으로 표시됩니다.
- 예 :becl 2 , bef 2 , c 2 H 2 , beh 2 등,
- sp 혼성화 :
- 1과 2 개의 p 궤도 블렌드, 3 개의 sp 를 형성합니다. 융합 (또는 하이브리드) 궤도.
- 그것은 또한 삼중 하이브리드 화라고도합니다.
- 그들은 같은 모양과 동일한 에너지를 가지고 있습니다.
- 그들은 한 비행기에 있습니다.
- 각 sp 하이브리드 궤도는 33%의 S- 차차와 66% P- character를 가지고 있습니다.
- 형성된 분자는 기하학의 삼각 평면이므로 결합 각도는 120 °입니다.
- sp 하이브리드 궤도는 S 및 2 개의 P 궤도를 혼합하여 얻어진다. 따라서, 그것은 삼각 공간 배열을 가지고있다.
- p- 궤도의 기여가 s- 궤도보다 많기 때문에 sp 의 모양입니다. 따라서 하이브리드 궤도는 배쪽으로 더 경향이 있습니다.
- 예 :beh 3 , bef 3 등, 및 알켄
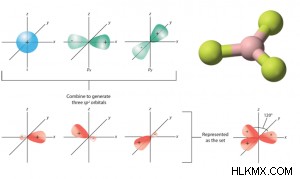
- sp 하이브리드 화 :
- 1 s 및 3 개의 p 궤도 intermix 4 개의 SP 복합재 (또는 하이브리드) 궤도를 형성합니다.
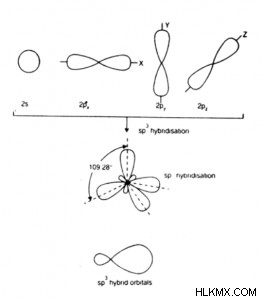
- 그것은 사면체 혼성화라고도합니다.
- SP 하이브리드 궤도는 동등하고 대칭적인 하이브리드 궤도입니다.
- 이것은 같은 모양과 동일한 에너지를 가지고 있습니다.
- 각 SP 하이브리드 궤도에는 14 개의 S-character와 34 개의 P 차주가 있습니다.
- 형성된 분자는 지오메트리의 사면체이며, 따라서 결합 각은 109.5 °입니다. 이를 사면체 각도라고도합니다.
- 예 :h 2 o, H , 2 s, c 2 h 6 , sicl 4 , ch 4 등,
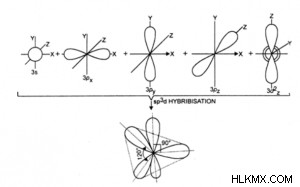
- sp d 하이브리드 화 :
- 1 s, 3 p, 1 개의 d 궤도 인터 믹스와 형식 5 sp d Intermix (또는 하이브리드) 궤도.
- 그것은 또한 삼각형 바이 파라미드 하이브리드 화라고도합니다.
- 이것은 같은 모양과 동일한 에너지를 가지고 있습니다.
- 형성된 분자는 형상의 삼각형 이피 라미드이므로 수평 평면에서 120 °, 수직 평면에서는 90 °의 결합 각도가 있습니다. .
- 그들은 일반 펜타곤 비 피라미드의 5 개의 모서리를 향한 것, 즉 우주에서 5 개의 하이브리드 궤도의 배열은 오각형 비 회화물이다.
- 예 :pcl 5 , sbf 5 , clf 3 , xef 2 등,
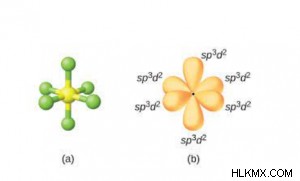
- sp d 하이브리드 화 :
- 1 s, 2 d 및 3 개의 p 궤도 intermix, 6 sp 를 형성합니다. d 하이브리드 궤도.
- 그들은 같은 모양과 동일한 에너지를 가지고 있습니다.
- 형성된 분자는 기하학적으로 팔각형이므로 결합 각인이 90 °입니다.
- 그들은 일반 (대칭) 팔면체의 6 개의 구석, 즉 우주에서 6 개의 하이브리드 궤도의 팔면체 배열을 향합니다.
- 예 :sf 6 , sef 6 , if
5 , xef 4 등, -
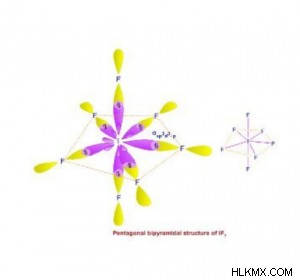
- sp d 하이브리드 화 :
- 1 s, 3 p 및 3d 궤도 intermix, 6 sp 를 형성합니다. d 하이브리드 궤도.
- 그들은 같은 모양과 동일한 에너지를 가지고 있습니다.
- 그들은 규칙적인 (대칭 적) 펜타곤 비 회화물의 일곱 모서리를 향해 지시됩니다.
- 형성된 분자는 형상의 삼각형 이피 라미드이므로 수평 평면에서 120 °, 수직 평면에서는 90 °의 결합 각도가 있습니다. .
- sp 를 보여주는 종의 𝜎 결합 쌍과 고독한 쌍의 합 d 혼성화는 항상 7입니다.
- 예 :if 7 , xef 6 , ref 7 등,
차트의 다양한 유형의 혼성화는 다음과 같습니다.
| 분자 유형 | 전자 쌍의 수 | 지오메트리 | 본드 각도 | 하이브리드 화 | 예 |
| ab 2 | 2 | 선형 | 180 ° | sp | becl 2 |
| ab 3 | 3 | Trigonal 평면 | 120 ° | sp | bf 3 |
| ab 4 | 4 | 사면체 | 109.5 ° | sp | ch 4 |
| ab 5 | 5 | Trigonal Bipyramidal | 90 °, 120 ° | spd | pcl 5 |
| ab 6 | 6 | 팔각형 | 90 ° | spd | sf 6 |
| ab 2 e | 3 | 구부러진 | 120 ° (119 °) | sp | so 2 |
| ab 3 e | 4 | Trigonal Bipyramidal | 109.5 ° (107.5 °) | sp | nh 3 |
| ab 2 e2 | 4 | 구부러진 | 109.5 ° (104.5 °) | sp | h 2 o |
| ab 4 e | 5 | See-Saw | 180 °, 120 ° (173.1 °, 101.6 °) | spd | sf 4 |
| ab 3 e2 | 5 | T-Shape | 90 °, 180 ° (87.5 °, <180 °) | spd | clf 3 |
| ab 2 e3 | 5 | 선형 | 180 ° | spd | xef 2 |
| ab 5 e | 6 | 사각형 피라미드 | 90 ° (84.8 °) | spd | brf 5 |
| ab 4 e2 | 6 | 사각형 평면 | 90 ° | spd | xef 4 |
| ab 7 | 7 | 국방부 비피라미드 | 90 °, 180 ° | spd | xef 6 |