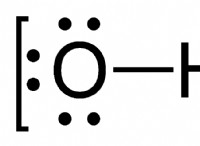a. 아연 보호 철
이것은 galvanic 부식 의 예입니다 . 아연은 철보다 더 반응성이므로 전자를 더 쉽게 산화시키고 (전자를 잃게됩니다). 아연이 철과 접촉하면 희생 양극을 형성합니다. 단순화 된 방정식은 다음과 같습니다.
Zn (s) + 2H⁺ (aq) → Zn²⁺ (aq) + h₂ (g)
* 설명 : 아연 (Zn)은 환경에서 수소 이온 (H⁺)과 반응하여 아연 이온 (Zn²⁺) 및 수소 가스 (HAT)를 형성합니다. 이 과정은 철의 부식을 방지합니다.
b. 알루미늄에 구리 도금
이것은 electroplating 의 예입니다 . 이 과정에서, 구리 질산염 용액의 구리 이온은 알루미늄 표면으로 감소된다. 전반적인 반응은 다음과 같습니다.
cu²u (aq) + 2e⁻ → cu (s)
* 설명 : 구리 질산염 용액으로부터의 구리 이온 (cu² ()은 알루미늄 표면에서 전자 (e⁻)를 얻어 알루미늄에 플레이트하는 고체 구리 (Cu)를 형성한다. 이 반응은 공정을 추진하기 위해 외부 전류가 필요합니다.
참고 : 알루미늄이 산화되는 경향이 있기 때문에 알루미늄 표면에서 발생하는 실제 반응은 더 복잡합니다. 그러나, 전반적인 반응은 상기 도시 된 바와 같이 단순화 될 수있다.