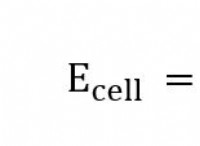기본
* 연료 : 수소 가스 (H₂)
* 산화제 : 산소 가스 (O ()
* 제품 : 물 (HATER) 및 전기
과정
1. 수소 산화 : 양극 (음성 전극)에서, 수소 분자는 양성자 (h⁺) 및 전자 (e⁻)로 분할된다. 이것은 백금 기반 촉매에 의해 촉매됩니다.
* h⁺ → 2h₂ + 2e⁻
2. 양성자 운동 : 양성자는 양성자 교환 막 (PEM)을 통과하여 양성자가 전자를 차단할 수 있지만 전자를 차단할 수있는 특수 물질이다.
3. 산소 감소 : 캐소드 (양성 전극)에서, 산소 분자는 양성자 및 전자와 반응하여 물 분자를 형성한다. 이것은 또한 백금 기반 촉매에 의해 촉매됩니다.
* o⁺ + 4H 4 + 4E⁻ → 2H₂O
4. 전자 흐름 : 양극의 수소 원자에서 방출 된 전자는 외부 회로를 통해 이동하여 전기를 생성합니다.
키 포인트 :
* 전기 화학 반응 : 전체 과정은 화학 에너지가 전기 에너지로 전환되는 전기 화학 반응입니다.
* 청정 에너지 : 수소 연료 전지의 유일한 부산물은 물이므로 매우 깨끗한 에너지 원입니다.
* 효율성 : 수소 연료 전지는 매우 효율적이며 수소에 저장된 화학 에너지의 상당 부분을 전기로 변환합니다.
* 응용 프로그램 : 연료 전지는 차량, 발전 및 휴대용 전자 제품을 포함한 다양한 응용 분야에서 사용됩니다.
프로세스 다이어그램 또는 연료 전지 작동의 특정 측면에 대한 자세한 내용을 원하시면 알려주세요!