Nernst 방정식은 무엇입니까?
Nernst 방정식은 알려진 온도, 압력 및 농도에서 전기 화학적 세포 전위를 계산합니다. 방정식은 비표준 조건에서 세포의 감소 전위를 표준 조건 (298k, 1 atm 및 1 m 농도)과 관련시킵니다.
.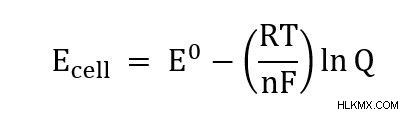
- e 셀 =세포 전위
- e =표준 조건 하에서 세포 전위
- r =범용 가스 상수 (8.314 J/(mol*k))
- t =온도
- n =반응에서 전달 된 전자의 수
- f =Faraday 상수 (96485 c/mol)
- q =반응 지수
Q는 반드시 평형을 제외하고는 평형 상수 (k)와 동일합니다. 비표준 셀 잠재력을 찾으려고 노력하고 있기 때문에 Q를 사용하는 것이 합리적입니다.
방정식은 다양한 전기 화학 세포에 대한 반 세포 반응 또는 세포 전위의 전위를 찾는 데 사용될 수 있습니다.
방정식은 또한 RT/NF라는 용어가 상수로 단순화되는 여러 다른 형태로 작성됩니다. 예를 들어, 방정식을 pH 방정식과 더 유사하게 만들려면 자연 로그를 로그로 변경할 수 있습니다.
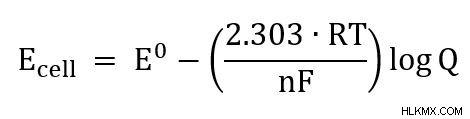
25C의 세포의 경우, 방정식은
로 단순화 될 수 있습니다.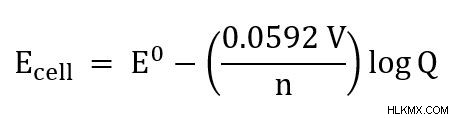
Nernst 방정식은 또한 반응물의 농도 증가에 대한 세포 전위의 증가를 결정하는데 유용하다. Q가 1이면 셀 전위보다 표준 세포 전위와 동일합니다. Q의 다른 값은 셀 전위가 표준과 다릅니다. 1 이상의 Q 값은 셀 전위가 표준보다 작다는 것을 의미합니다. Q 값 1보다 작은 값은 표준보다 높을 것임을 의미합니다.
세포 전위가 더 긍정적이되면 반응이 더 많이 발생할 가능성이 높습니다.
Nernst 방정식의 파생
Nernst 방정식은 Gibbs Free Energy에서 파생됩니다.
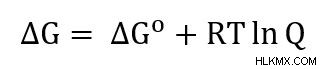
ΔG =-nfe 및 ΔG =-nfe의 정의를 사용 하여이 방정식을 다시 작성할 수 있습니다.
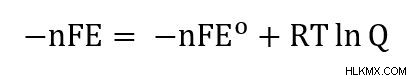
단순화하기 위해, 우리는 각면을 -nf로 나누고 일반적으로 쓰여진대로 Nernst 방정식에 도달합니다.
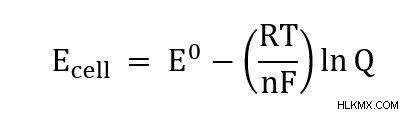
예제 방정식을 사용하는 문제
문제 :납 (PB)과은 (AG)이 25c에서 실행되는 전기 화학 셀이 있습니다. 세포의 반응은 아래에 나열되어 있습니다.
PB (S) + 2 Ag (AQ) -> PB (AQ) + 2AG (S)
[Ag+] =0.75 m 및 [pb2+] =0.1 M에서 세포 전위를 계산하십시오. 표준 세포 전위는 0.93 v.
입니다.작업 솔루션 :
먼저, 발생하는 반응을 기록하고 표준 세포 전위 (E)가 아직 제공되지 않은 경우 찾으십시오. 이 경우, 반응 및 세포 잠재력은 문제에 주어진다. 표준 세포 전위를 찾는 방법에 대한 생각을 보려면 전기 화학 세포에 대한 자습서를 참조하십시오.
둘째, 주어진 값 또는 알려진 값을 Nernst 방정식에 연결합니다. 이 문제에서는 N, Q 및 E를 연결할 수 있습니다. 가스 상수 (R) 및 Faraday 상수 (F)는 0.0592 V의 값으로 단순화 된 상수입니다.이 단순화는 25C에서 작동하기 때문에 가능합니다.
.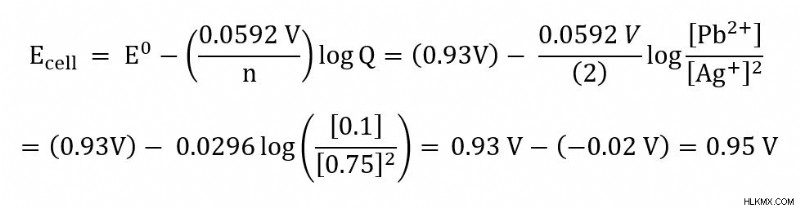
Q의 경우 반응의 고체 성분이 값에 포함되지 않음을 상기시켜줍니다. 따라서이 예에서는 PB (S) 및 AG (S)가 포함되지 않습니다. 우리의 n 값은 우리의 반응에서 2 몰의 전자가 전달되는 것을 보는 것에서 비롯됩니다.
문제를 해결할 때 유닛을 확인하여 올바른 장치로 끝나는지 확인하십시오. 특히 25c에서 작동하는 데 단순화 된 계수를 사용할 수없는 경우
.Nernst 방정식의 한계
Nernst 방정식의 한계가 자주 진행되지는 않지만 방정식과 관련된 몇 가지 가정이 있습니다. 아래는 Nernst 방정식이 부정확 해지는 일부 상황입니다.
- 농도가 매우 높으면 Nernst 방정식이 부정확 해집니다. 반응물 또는 생성물의 농도가 매우 높은 실험이되어 잠재력을 결정하는 데 사용됩니다.
- 매우 희석 된 솔루션에서 예측 된 잠재력은 무한대에 도달 할 수 있으며, 이는 현실적이지 않고 무시되어야합니다.
- 셀을 통해 전류가 흐르면 방정식을 사용할 수 없습니다. 전류는 이온의 활성 (유효 농도)을 변화시킨다. 이 효과는 방정식이 부정확합니다.
재미있는 사실 :
- 독일 화학자 인 Walther Hermann Nernst (1864-1941)는 방정식을 개발했습니다.
- Nernst는 1920 년에 열화 화학에 관한 작업으로 노벨 화학상을 받았습니다.
- Nernst에 의해 일반적으로 알려진 또 다른 발견은 열역학의 제 3 법칙입니다.
- 전기 화학적 세포 전위는 Nernst 방정식의 주요 응용 중 하나입니다. 전기 화학 셀은 대부분의 유형의 배터리를 운전하는 것입니다! 이 세포는 또한 보석에 금을 뽑는 것과 같은 얇은 재료의 재료를 다른 표면에 플레이트하는 데 사용될 수 있습니다.
추가 읽기
- 전해 세포 및 전기 분해
- 볼타 세포 및 갈바니 세포
- 표준 감소 전위
- 평형 상수
- 깁스 자유 에너지
- 브라운 운동