용어 이해
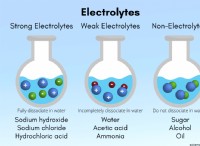
* molality (m) : 몰이는 용매 킬로그램 당 용질의 두부를 발현하는 농도의 척도이다. 이 경우 물 킬로그램 당 NaCl의 두더지입니다.
* 용질의 질량 : 용질의 질량은 NaCl (806g)의 질량입니다.
용액의 질량을 계산하는 단계
1. NaCl의 두더지를 계산합니다 :
* NaCl의 몰 질량은 약 58.44 g/mol입니다.
* NaCl의 두더지 =(NaCl의 질량) / (NaCl의 몰 질량)
* NaCl의 두더지 =(806 g) / (58.44 g / mol) ≈ 13.79 mol
2. 물 질량을 계산 :
* molality (m) =(용질의 몰) / (kg에서 용매의 질량)
* 용매 질량을 해결하기 위해 공식을 재 배열하십시오.
* 용매의 질량 (kg) =(용질의 몰) / (molality)
* 용매 질량 (kg) =(13.79 mol) / (2.48 m) ≈ 5.56 kg
* 물 질량을 그램으로 변환하십시오.
* 용매 질량 (g) =5.56 kg * 1000 g/kg =5560 g
3. 용액의 총 질량을 계산하십시오.
* 용액의 질량 =용질 질량 + 용매 질량
* 용액 질량 =806 g + 5560 g =6366 g
따라서 용액의 질량은 약 6366 그램입니다.