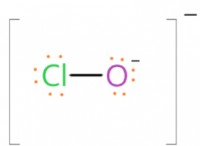CO2 및 탄산 산의 형성
* 용해도 : 이산화탄소는 물에 약간 용해됩니다. 용해되면 물 분자와 반응하여 탄산산 (H2CO3)을 형성합니다.
* 반응 : CO2 (g) + H2O (L) ⇌ H2CO3 (AQ)
* 평형 : 이 반응은 가역적이므로 양방향으로 갈 수 있습니다. 평형은 탄산의 형성을 선호하지만 형성된 양은 제한적이다.
카본 산 및 산도
* 해리 : 탄산은 약산입니다. 물에 부분적으로 분리되어 수소 이온 (H+) 및 중탄산염 이온 (HCO3-)을 방출합니다.
* h2co3 (aq) ⇌ h + (aq) + hco3- (aq)
* 산도 증가 : 용액으로의 수소 이온 (H+)의 방출은 산도를 증가시킨다. 이것이 과도한 CO2의 솔루션이 더 산성이되는 이유입니다.
초과 CO2의 영향
* 평형 변화 : CO2가 과잉으로 존재할 때, 반응의 평형은 더 많은 탄산의 형성을 선호한다. 이것은 농도의 H+ 이온 농도를 초래하여 용액을 더욱 산성으로 만듭니다.
* pH 변화 : 용액이 더 산성이되면 pH가 감소합니다. pH 척도는 산도를 측정하며, 더 낮은 값은 더 큰 산도를 나타냅니다.
예 :
* 해양 산성화 : 대기의 과도한 CO2는 바다에 녹아 해수의 산도를 증가시킵니다. 이것은 해양 생물에 위협이됩니다.
* 소다 팝 : 소다의 피즈는 용해 된 CO2에서 나옵니다. 형성된 탄산은 소다 산성을 만듭니다.
요약 : 용액에서 과량의 CO2는 탄산을 형성함으로써 산도를 증가시킨 다음 부분적으로 분리되어 수소 이온을 방출한다. 이 과정은 pH 값이 낮아서 더 산성 용액을 나타냅니다.