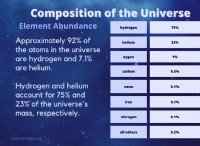
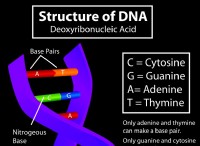
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D
이것을 이해하는 방법은 다음과 같습니다.
* 1s² :첫 번째 에너지 레벨 (n =1)에는 2 개의 전자를 담을 수있는 하나의 서브 쉘이 있습니다.
* 2s² 2p⁶ :두 번째 에너지 수준 (n =2)에는 각각 2 및 6 전자를 유지할 수있는 두 개의 서브 쉘 (S 및 P)이 있습니다.
* 3S² 3p⁶ :세 번째 에너지 수준 (n =3)에는 각각 2 및 6 전자를 유지할 수있는 두 개의 서브 쉘 (S 및 P)이 있습니다.
* 4S² :네 번째 에너지 수준 (n =4)에는 2 개의 전자를 담을 수있는 하나의 서브 쉘이 있습니다.
* 3d 3 :세 번째 에너지 수준 (n =3)에는 실제로 최대 10 개의 전자를 유지할 수있는 세 번째 서브 쉘 (d)이 있습니다. 망간의 경우,이 서브 쉘에 5 개의 전자가 있습니다.
전자는 에너지를 증가시키기 위해 궤도를 채우고, 4S 궤도는 에너지가 낮기 때문에 3D 궤도 이전에 채워진다는 것을 기억하십시오. 그러나, 3D 서브 쉘은 4S보다 핵에 더 가깝기 때문에 3D 서브 쉘의 전자는 핵에 더 강력하게 끌려 제거하기가 더 어렵다. 그렇기 때문에 3D 서브 쉘이 긴 전자 구성에서 4S 이후에 표시되는 이유입니다.