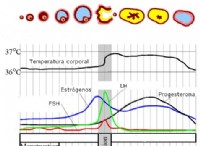
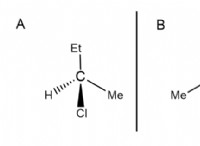
1. 전자 결핍 종 :
* 금속 양이온 : 이들은 불완전한 옥셋을 가지며 전자 쌍을 허용 할 수 있습니다. 예로는 Al³⁺, Fe³⁺ 및 Cu²⁺가 포함됩니다.
* 불완전한 옥넷이있는 그룹 : 여기에는 붕소 (B), 알루미늄 (AL) 및 실리콘 (SI)과 같은 그룹 3, 4 및 5의 요소가 포함됩니다. 예를 들어, BF₃는 루이스 산입니다.
* 탄소 : 이들은 불완전한 옥셋을 갖는 양으로 하전 된 탄소 종이다.
2. 극성 결합이있는 화합물 :
* 할로겐 : 이들은 전기 음성이 높고 극성 결합을 형성하여 중앙 원자 전자를 결핍시킬 수 있습니다. 예로는 Alcl₃ 및 Bf₃가 있습니다.
* 금속 할로드 : 할로겐과 유사하게, 이들은 극성 결합을 형성하고 루이스 산 역할을 할 수 있습니다. 예로는 feclec 및 sncl₄입니다.
* 극성 결합이있는 다른 화합물 : 극성 결합을 가진 일부 화합물은 또한 SO₂ 및 Co₂와 같은 루이스 산 역할을 할 수 있습니다.
3. 빈 궤도가있는 화합물 :
* 전이 금속 이온 : 많은 전이 금속 이온에는 전자 쌍을 수용 할 수있는 빈 D 궤도가 있습니다. 예로는 Co²⁺, Ni²⁺ 및 Zn²⁺가 있습니다.
* 빈 p 궤도 : 붕소 트리 플루오 라이드 (BF₃)와 같은 빈 P 궤도가있는 화합물은 루이스 산 역할을 할 수 있습니다.
중요한 참고 : 위의 특성을 가진 모든 화합물이 항상 루이스 산이되는 것은 아닙니다. 특정 조건 (온도, 용매 등)과 관련된 다른 반응물의 특성은 그들의 행동에 영향을 줄 수 있습니다.
루이스 산의 반대편이 루이스베이스라는 것을 기억하는 것도 중요합니다. , 이것은 전자 쌍을 기증 할 수있는 화합물입니다.