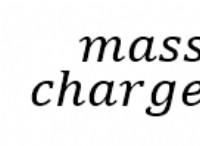이유는 다음과 같습니다.
* kw =[H+] [OH-] =1.0 x 10^-14 25 ° C에서. 이것은 수소 이온 농도 및 수산화물 이온 농도의 생성물이 항상 일정하다는 것을 의미합니다.
* [OH-]가 증가하면 kw의 일정한 값을 유지하기 위해 [h+]가 감소해야합니다.
간단한 용어로 :
시소처럼 생각하십시오. 한쪽 (OH-)에 더 많은 무게를 추가하면 SeesAW의 균형을 유지하려면 다른 쪽 (H+)이 더 가벼워 야합니다.
이 관계는 pH와 poh를 이해하는 데 필수적입니다. 수산화물 농도가 증가함에 따라, 용액은 더 기본화되고 (높은 pH) 수소 농도가 감소한다.