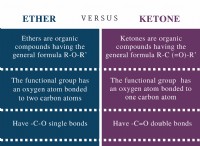
수용성 용해도에 대한 핵심 사항 :
* 용해도는 역동적 인 과정입니다 : 여기에는 용해 속도 (용액으로의 물질)와 결정화 속도 (용액에서 나오는 물질) 사이의 균형이 포함됩니다.
* 용해도는 몇 가지 요인에 따라 다릅니다.
* 온도 : 일반적으로 온도에 따라 용해도가 증가합니다.
* 압력 : 가스의 경우 압력에 따라 용해도가 증가합니다.
* 극성 : 비슷한 극성을 가진 물질은 서로 더 잘 녹는 경향이 있습니다. 물은 극성 용매이므로 극지 및 이온 물질을 더 잘 용해시킵니다.
* 분자간 힘 : 용질과 용매 사이의 분자간 힘의 강도는 용해도에 영향을 미칩니다.
* 용질의 크기와 모양 : 더 작고 더 콤팩트 한 분자는 더 가용성이있는 경향이 있습니다.
* "원리 :처럼 녹는 것처럼 이 원리는 극성 용매가 극성 용질을 용해시키고 비극성 용매는 비극성 용질을 용해시킨다.
* 포화 솔루션 : 포화 용액은 주어진 온도에서 용해 될 수있는 최대 용액의 용액을 포함하는 용액입니다.
* 불포화 솔루션 : 불포화 용액은 포화 점보다 덜 용질을 함유합니다.
* 과포화 솔루션 : 과포화 용액은 포화 점보다 더 많은 용질을 함유합니다. 이 용액은 불안정하고 과도한 용질은 방해가되면 침전 될 것입니다.
수성 용해도가 다양한 물질의 예 :
* 매우 가용성 : 테이블 소금 (NaCl), 설탕 (C₁₂h₂₂o₁₁)
* 적당히 가용성 : 탄산 칼슘 (카코 ₃)
* 낮은 용해도 : 염화은 (AGCL)
* 불용성 : 오일, 지방, 왁스
수성 용해도를 이해하는 것은 다음과 같은 다양한 분야에서 중요합니다.
* 화학 : 화학 반응을 예측하고 설명합니다.
* 생물학 : 세포에서 생체 분자의 행동을 이해합니다.
* 의학 : 약물 전달 시스템 설계 및 약물 상호 작용 이해.
* 환경 과학 : 수역에서 오염 물질의 운명을 평가합니다.