Pauli 제외 원리 정의
Pauli 배제 원리는 임의의 원자에서 전자가 다른 전자 양자 수를 다른 전자와 동일한 4 개의 전자 양자 수를 가질 수 있다고 명시하고있다. 모든 전자마다 양자 수가 있어야합니다. 따라서, 각 전자 궤도에서 (동일한 n , l, 및 m l ) 두 개의 전자가있을 수 있으며 스핀이 다르아야합니다. 하나의 전자에는 m s 가 있습니다 =+ ½과 다른 m s =- ½. 따라서 두 개의 전자는 동일한 4 개의 양자 수를 가지지 않습니다.
스핀 양자 수 ( m s ) 이전에 발견 된 3 개의 양자 수에 추가되었습니다 ( n , l , m l ) Pauli 배제 원칙에 의해. 양의 m s 일반적으로 스핀을 나타내며 상향 포인팅 화살표로 표시됩니다. 부정적인 m s 일반적으로 스핀 다운을 나타내며 다운 페이스 화살표로 표시됩니다. 스핀 양자 수는 다른 양자 수와 약간 다릅니다. 값은 + ½ 또는 ½의 값을 가질 수 있으며이 값은 다른 모든 양자 수와 무관합니다. 다른 양자 수는 모두 서로 연결됩니다.

원리는 또한 각 궤도에 두 개의 전자 만 가질 수 있음을 정의합니다. 이 정의는 처음 3 개의 양자 번호로 정의되는 궤도에서 비롯됩니다. 나머지 양자 스핀 번호에는 두 가지 가능한 값 만 있습니다. 따라서 Pauli 배제 원칙의 정의에 따르면, 궤도는 두 개의 전자 만 담을 수 있습니다.
Fermions vs. Bosons
이 원칙은 모든 fermions에 적용됩니다. 페르미온은 반 인구 스핀을 갖는 원자 입자이다. 일반적으로 알려진 페르미온은 전자, 양성자 및 중성자입니다. 따라서이 모든 입자는 Pauli 배제 원리를 따릅니다.
Fermion에 대한 대안은 Boson입니다. 가슴에는 정수 스핀이 있습니다. 가장 일반적인 보손은 광자입니다. 하나의 에너지 상태에는 많은 광자가있을 수 있습니다. 한 상태에서는 모두 동일한 양자 수를 가지고 있습니다. 이것은 Pauli 배제 규칙을 위반 한 것입니다. 그러나 광자는 가슴이기 때문에 Pauli 배제 규칙을 따르지 않습니다.
화학에서 Pauli 배제 원칙의 적용
원자의 전자 쉘 구조를 결정할 때는 Pauli 배제 원리가 중요합니다. 그것은 우리가 어떤 전자 궤도가 채울 지 알 수 있도록 Aufbau 원리와 쌍을 이룹니다. Pauli 배제 원칙을 사용하여 궤도에 두 개의 전자가 있으면 하나는 스핀 업 (+ ½)이어야하며 하나는 다른 양자 수를 제공하기 위해 스핀 다운 (-5)이어야합니다. 그러나 궤도에 전자가 하나만 있으면 양수 또는 음의 스핀을 가질 수 있습니다.
Pauli 배제 원리의 발견은 또한 주기율표에서 일부 현상과 일부 원자가 어떻게 결합하는지에 대한 이유를 설명하는 데 도움이되었습니다. 특히 고체의 경우, 이전에 설명 할 수없는 많은 속성을 Pauli 배제 원칙을 사용하여 설명 할 수있었습니다.
예제 문제
헬륨
가장 간단한 원자는 헬륨입니다. 헬륨은 1s 궤도에 2 개의 전자를 가지고 있습니다. 1s 궤도는 양자 수 n 을 갖는다 =1, l =0, m l =0. 두 전자 모두이 서브 쉘에있을 것입니다. 따라서, 하나의 전자는 양자 수 n 을 가질 것이다 =1, l =0, m l =0, 그리고 m s =+1/2. 다른 전자는 양자 수 n 을 가질 것이다 =1, l =0, m l =0, 그리고 m s =-1/2.

베릴륨
베릴륨에는 1과 2s 궤도를 채우는 4 개의 전자가 있습니다. 다음은 Pauli 배제 원리를 위반하는 전자 구성의 일부 예와 올바른 묘사입니다.
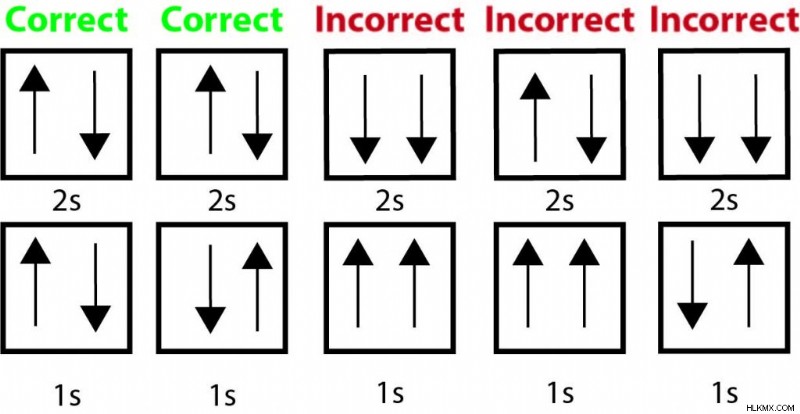
모든 잘못된 옵션에는 동일한 궤도에서 같은 방식으로 (동일한 스핀을 나타내는) 화살표가 있습니다. 이것은 그들이 동일한 4 개의 양자 수를 가지고 있고 Pauli 배제 원칙을 위반할 것임을 나타냅니다.
다음으로, 우리는 또한 각 전자의 양자 수를 나열하여 전자가 동일한 4 개의 양자 수를 갖는 것을 확인할 수 있습니다.
우리는 1s 쉘을 채워서 시작합니다. 그것은 주요 양자 번호 n 을 의미합니다 S- 궤도는 1과 동일합니다. .
- 전자 1 : n =1, l =0, m l =0, 그리고 m s =- ½
- 전자 2 : n =1, l =0, m l =0, 그리고 m s =+ ½
그것은 1s 쉘을 채 웁니다. 다음 껍질은 2S이며, 이는 주요 양자 수 n 를 변경합니다. 2 ~ 2.
- 전자 3 : n =2, l =0, m l =0, 그리고 m s =- ½
- 전자 4 : n =2, l =0, m l =0, 그리고 m s =+ ½
4 개의 전자의 양자 수를 비교하면 그 중 어느 것도 동일하지 않습니다. 결론적으로, 그들은 Pauli 배제 원칙을 따르고 있습니다.
Pauli 배제 원칙의 역사
Pauli 배제 원칙은 1925 년 Wolfgang Pauli에 의해 발견되었습니다.이 원칙은 Bohr 모델로 확장되었습니다. 원칙이 처음 발견되었을 때, 그는 전자에만 적용했습니다. 나중에이 원칙은 1940 년 Pauli에 의해 모든 페르미온으로 확대되었습니다.
Wolfgang Pauli는 1945 년 양자 화학 분야의 발견과 일로 노벨 물리학 상을 받았습니다. 그는 또한 제만 효과를 설명하기 위해 노력했으며 중성미자의 존재를 제안했습니다. Pauli는 1900 년 오스트리아에서 태어나 1958 년에 사망했습니다.